Перспективы лечения наследственных болезней. Генотерапия. Медико-генетическое консультирование.
известно около 2000ген заб. Изучение и возможное предотвращение последствий ген дефектов Ч — предмет мед Г. Наследственные болезни можно подраздёлить на 3 гр: болезни обмена веществ (альбинизм, алкаптонурия, тирозиноз, фенилкетонурия), молекулярные болезни, кот вызываются генными мутациями (гемоглобинопатия), и хромосомные болезни (тип нас заб связан с изменениями числа или структуры хромосом).
Моносомия всего организма для Х-хромосомы (синором Щерешевского). Женщины-трисомики с кариотипом 47, XXX нормальны в умственном и физическом отношении, плодовиты и не обнаруживают отклонений в половом развитии. С увеличением числа Х увеличивается частота отклонения от нормы: умственная неполноценность, аномалии зубов, нарушения формы черепа, изменения других частей скелета, нарушение :системы половых органов. Различные комбинации Х- и У-хромосом при полисемии по половым хромосомам, кроме ХУУ, объединяют под общим названием синдрома Клайнфельтера. Из числа аутосомных болезней наиболее подробно изучена трисомия по 21-й хромосоме, или синдром Дауна.
Меры, принятые при раннем выявлении наследственных болезней, могут предотвратить их развитие. Диетологические меры позволяют избежать патологических последствий, например при галактоземии, фенилкетонурии и других наследственных болезнях обмена.
Плейотропия, специфические проявления мутантных признаков характерны для наследственной изменчивости, говорить об излечении нельзя, поскольку причина болезни — изменение генетического материала.
пренаталъная диагностика, метод амниоцентеза (можно опр более 100 хромосомных и генных аномалий в первые недели беременности, возможно прерывание беременности.) Выяснение метаболических и молекулярных причин наследственного заболевания дает возможность компенсировать дефект в порядке модификационных изменений — фенокопировать норму. (при гемофилииА синтетич фактор свёрт кр VIII,ген его рекордно большой, след ввели выделенный по частям и сшитый из кусочков в кл китайского хомячка )
Выделение и клонирование нормальных генов человека все больше позволяет надеяться на то, что возникнет новая отрасль медицины — генотерапия. Генотерапия позволит заменять дефектные гены нормальными и тем самым устранять причину болезни, а не ее симптомы.
Медико-генетическое консультирование определение гетерозиготного носительства, т. е. выявление в популяции индивидуумов, которые сами не страдают от наследственного заболевания, но гетерозиготны по рецессивной мутации, которая способна его вызвать. вычислить вероятность появления у них потомка — гомозиготного по рецессивной аллели.
38 Близнецовый метод в генетике человека. Моно‑ и дизиготные близнецы. Конкордантность и дискордантность.
Близнецовый метод — изучение генотипических и фенотипических особенностей однояйцевых и разнояйцевых близнецов. Результат изучения — определение относительного значения наследственности и окружающей среды в формировании и развитии человеческого организма.
Монозиготные близнецы образуются из одной зиготы, разделившейся на стадии дробления на две (или более) части. Они обладают одинаковыми генотипами. Монозиготные близнецы всегда одного пола. Дизиготные близнецы развиваются в том случае, если одновременно две яйцеклетки оплодотворены двумя сперматозоидами. Естественно, дизиготные близнецы имеют различные генотипы. Они сходны между собой не более, чем братья и сестры, т.к. имеют около 50 % идентичных генов. Общая частота рождения близнецов составляет примерно 1 %, из них около 1/3 приходится на монозиготных близнецов. Известно, что число рождений монозиготных близнецов сходно в разных популяциях, в то время как для дизиготных это число существенно различается. Например, в США дизиготные близнецы рождаются чаще среди представителей негроидной расы, чем среди представителей европеоидной расы. В Европе частота появления дизиготных близнецов составляет 8 на 1000 рождений. Однако в отдельных популяциях их бывает больше. Самая низкая частота рождения близнецов присуща монголоидным популяциям, особенно в Японии. Полагают, что многоплодие генетически обусловлено. Однако это справедливо лишь для дизиготных близнецов. Факторы, влияющие на частоту рождения близнецов, в настоящее время мало изучены. Есть данные, показывающие, что вероятность рождения дизиготных близнецов повышается с увеличением возраста матери, а так же порядкового номера рождения. Влияние возраста матери объясняется, вероятно, повышением уровня гонадотропина, что приводит к учащению полиовуляции. Имеются также данные о снижении частоты рождения близнецов почти во всех индустриальных странах. Отмечается, что частота врожденных уродств у близнецов, как правило, выше, чем у одиночно рожденных.
Основоположник близнецового метода – Ф. Гальтон, который предложил сравнивать близнецов для выяснения влияния наследственности на проявление признаков. Близнецовый метод основан на 3 положениях:
1. ОБ имеют идентичные генотипы, а РБ – различные генотипы.
2. Среда, в которой развиваются близнецы и под действием которой появляются различия признаков ОБ, может быть одинаковой и неодинаковой для одной и той же пары ОБ.
3. Все свойства организма определяются взаимодействием генотипа и среды.
ОБ и РБ обычно сравнивают по ряду показателей на большом материале. На основе полученных данных вычисляют показатели конкордантности(частоты сходства) и дискордантности(частоты различий). Данные показывают, что у ОБ конкордантность значительно выше, чем у РБ, однако степень сходства различных признаков варьирует.
Н=(М%-Д%)/(100-Д%), где Н – доля наследственности, М – конкордантность у ОБ, Д – конкордантность у РБ.
| ОБ | РБ | |||
| Группы крови | ||||
| Форма бровей | ||||
| Цвет глаз | 99,5 | |||
| Цвет волос | ||||
| Косолапость | ||||
| Даун | ||||
| Рак | ||||
| Эпилепсия | ||||
| шизофрения | ||||
39. В настоящее время ген определяют как структурную единицу генетической информации, далее неделимую в функциональном отношении. Ген представлен участком молекулы ДНК (реже РНК). Понятие гена как дискретной единицы, выявляемой менделевским гибридологическим анализом, ввел В. Л. Иоганнсен в 1909 году.
Т. Х. Морган 1926 “Теория гена”: ген это –
1. единица мутации, т. е. Ген изменяется как целое
2. ед. рекомбинации, т.е. кроссинговер никогда не наблюдается в пределах гена
3. ед. функции, т.е. все мутации гена нарушают одну и ту же генетическую ф-ю, что выражается в их некомплементарности у особей F1 при попарном скрещивании мутантов.
Геномика – наука о геноме. Геном – вся совокупность генов (бывает ядерный, пластидный, митохондриальный геном). Геномика бывает:
1. Структурная – структурная организация генома в целом
2. Функциональная
3. Эволюционная
Геном состоит из:
· Гены 3-5%
· Подвижные элементы 20-45%
· Сателлитные ДНК, микросателлитные ДНК
Метод Microarray – изучает экспрессию всех генов.
40. Трансформация (ТФ)
Трансформация баков - перенос ДНЛ, изолированной из одних клеток в другие. При ТФ ДНК, выдел. из кл. одного штамма, поглощают кл. др. штамма - реципиента. С пом. генет. маркеров об этом м. судить по измен. фенот. реципиента.
ТФ не возможна у некот. бактерий: Diplococcus, Hemophilus, Neisseria, Bacillus, актиномицетов, циано-бакт. Лучше всего изуч. у D/ pneumonia, B. subtilis, H. influenzae.
Для того чтобы ДНК проник. в бак. кл, кл. долж наход. в сост. компетентности. Компет-сть приобрет. лишь частью кл. обыч. в серед. логарифмической стад. роста (способ. особ. белок)( если есть хлорамфеникола – ингибитор. белк. синтеза комп. не разв; добавл. антибиотик к компетентн.- не подавл.). => белок, стим. комп-сть, вырабат. в ходе роста.
ДНК связ. с -тью компет. кл ,эта ДНК имеет Mr= 1 • 107 Д, 0,5 % бак. хромос..-> связан. ДНК расщепл. спец. нуклеазами до фрагмент. с Mr= 4—5- 106Д. -> Фрагменты ДНК проник. в кл. Некот. (пневмококки) могут неспец. поглощать ДНК из разл. источн. Некот (Hemophilus) поглощ. лишь свою(гомологическую ДНК). Фрагменты менее 5- 105 Д в клетку не проникают.
В баке 2цепоч. ДНК превращ. в 1цепоч.: 1 нить деградирует. На заключительной стадии происх. интеграция 1цепоч. трансформирующего фрагмента с ДНК клетки-реципиента. Репликация не треб.,включаемый фрагм. физич. объед. с ДНК реципиента. Весь процесс 10—30 мин. Частота 1 %.
Для некот. бак. показ. ТФ в естеств. усл. (в инфицир. жив. Diplococcus, в культуре - для Bacillus subtilis.) =>ТФ естеств. биологический процесс.
В то же время в последние годы в связи с развитием генной инженерии широко применяется плазмидная, или векторная, трансформация, которая заключается во введении в кл. бакт., а также эукариот генов, интегрирован. в естеств. или искусств. плазмиды.
41-42. Трансдукция(ТД)
перенос генов из одних бакт. кл. в др. при помощи бактериофага(БФ).В 1951 г. откр. Зиндер.
БФ(вирусы бакт.), делят на 2 категор.: вирулентные и умеренные. Вирулен. БФ (фаг), проник. в кл., вызыв. лизис. Умеренные БФ м. вызыв. как литич., так и лизоген. ре-цию. Лизогенн. р-ция: инфицирующ. фаг переход. в сост. профага, кот. воспроизв. синхронно с хромос. бакт. (баки с профагом –лизогенными). Лизоген. баки приобрет. устойчивость к доп. заражению тем же бактериофагом..
Лизогенное сост.устойчиво воспроизв. Профаг теряется с частотой 1 на 105—106 кл. делений. В культурах может происходить индукция бактериофага=> массовый лизис бакт-ий. Такое явление стимулируется: ультрафиол и рентг. лучами, алкилирующими соед-ми. Умерен. фаг м. вызвать и лизогенную реакцию. Завис.от физиол. сост. культуры. Умеренные БФ м. мутационным путем превращаться в вирулентные.
Общая, или неспецифическая ТД. ТД осущ. умер. БФ. (Р22 -Зиндер впервые обнаружил транс-дукцию у Salmonella typhimurium)
Два штамма это бакт., нуждавш. в ам.к-тах (phe trp tyr + + и - + + + met his) в смешанной культуре на min среду.=> прототрофные колонии с частотой око 1 X 10-4. Для их образования не нужен контакт между клетками, как при конъюгации.
Фильтрующийся агент, переносящий гены – умерен. БФ Р22, по кот. был лизогенным один из штаммов. Фаг Р22 мог трансдуцировать любые гены сальмонеллы => общая или неспецифич. ТД. (так. же способн. у Р1 Е. coli - переносит небол. фрагм. хромосомы Е. coli.. Напр. совмест. ТД генов thr и leu 1 % случаев, хотя на ген. карте Е. coli, построенной при конъюгации, эти локусы тесно сцеплены и находятся на расст. 2 % общей длины генома.
Общая ТД -следствием включения фрагментов ДНК Е. coli, зараженной фагом Р1, в инфекц. частицы БФ. Такие частицы не сод. или мало фаговой ДНК. => трансдуктан-ты не обладают иммунитетом к фагу Р1. ТД могут осущ. даже вирулентные мутанты Р1. => что ТДющие частицы не способны инициировать норм. цикл развития фага. Иначе кл. д.б. погибнуть.
Перенос генов при Общ.ТД привод.: привнесенный ген наследуется стабильно, т.к интегрирует с хромосомой реципиента -полная ТД. При абортивной ТД внесенный фагом фрагмент генома не реплицируется и передается по одной линии при размножении.Т.е одна кл. при делении получает трансдуцированный ген. Так можно трансдуцировать ген, опред. наличие жгутика у S. typhimurium.-подвижность сохраняет только одна клетка. Абортивная чаще, чем полная, иногда в 10 раз.
Спец ТД отличается от неспец. тем, что БФ может переносить лишь опред. гены (хар-но для фага λ Е. coli - только гены локуса gal, ответств. за усвоен. галактозы, и bio -синтез биотина).
Умерен. БФ λ при лизогенизации Е. coli интегрирует в ее хромосому на участке между локусами gal и bio(конъюгацион/ скрещив/ лизогенных Hfr и нелизогенных F—бакт.. Gal+-трансдукт. возник. I X 10-5 —10-6 (генет. нестабильны, выщепляют клетки Gal-1 с частотой около 2 X 10-3 на кл. деление, т.к. трансдуктанты Gal+ частично гетерозиготны gal/gal+, т. е. несут дополнительный фрагмент gat+ вместе с участком gal реципиента( гетерогенота).
При облуч. гетерогенот ультрофиол.-> фаголизаты (частота ТД очень выс.) ½ частиц λ могла передав. признак Gal+при ТД. Фаги из этих лизатов HFT(high frequently ТД). Гены переносят дефектные фаги λ (кот. лизогенизируя бактерии, сообщ. им устойчивость к суперинфекции λ, но баки не продуц. инфекц. частицы БФ. деф. трансдуц. част. λ не образуют стерильных пятен на газоне Е. coli. .Самостоятельно не размнож. Требуется фаг-помощник(не спос. к ТД)
У дефект. фагов λ gal от 1/4 до 1/3 собств. генома замещ. на gal — участок бактериальной хромосомы.
Сайт-специфическая рекомбинация(ССР). Геном фага λ проник. в бак. в линейной форме,на концах ДНК есть липкие концы — однонитевые участки по 12 нуклеотидов, комплементарные друг другу. В клетке ДНК замык. в кольцо-> интегрирует в геном бактерии. Принцип интеграции: кольцо генома λ реципрокно рекомбинир. с кольц. бакт. хром.. Один обмен-> интеграции ДНК фага λ с ДНК бакт.. Интеграция профага может происх. только в одном месте на хромосоме E. coli, названном att A. (attachment site A.). Аналогичный уч. есть в геноме БФ. Рекомбинация происх. в отсут. протяженной гомологии. Общим у фага и бактерии оказался участок в 15 ам.ост. Вырезание (эксцизия) профага из хромосомы-по тому же мех-му реципрокной, сайт-специфической рекомбинации. Как интеграцию и эксцизию профага А, контролируют два фаговых гена: int и xis. ССР- точно, но не безошибочно. 1на 1 млн. при эксцизии профага рекомбинация осуществляется не в аtt, а захватывает участки gal или bio. Так возникают трансдуцирующие частицы, у кот. часть генетического материала профага замещена генами бактерии. В рекомбинацию вовлек. те же 15 пар нуклеотидов, кот. встр. в генах gal и bio. За пределами этих 15 п. н. гомология отсутствует. CCР проводит фермент интеграза, кодируемый локусом int фага λ.
Использование в ген. анализе: при картировании 1-2 мин карты, где необх. катрирование по 3 точкам., катрирование на коротких. участках(P1). Об относительном расположении маркеров при ТД судят по частоте совмест. включения в част БФ при селекции трансдуктантов по одному из них (коТД).Аналогично при ТФ.
43.Плазмиды — дополнительные факторы наследственности, расположенные в клетках вне хромосом и представляющие собой кольцевые замкнутые) или линейные молекулы ДНК.
Плазмиды способны удваиваться (реплицироваться) автономно, но при этом они эксплуатируют репликационную систему клетки хозяина.
Большинство плазмид кодирует специальные белки — инициаторы репликации. Эти белки начинают процесс репликации, который затем подхватывается и продолжается репликационной системой клетки. Для кольцевых плазмид известны несколько механизмов (способов) репликации:
- механизм катящегося кольца (rolling cycle)
- тетта-механизм (механизм «глазка»)
- D-механизм
Некоторые плазмиды могут с определенной частотой интегрироваться в бактериальный геном и размножаться затем вместе с ним как его составная часть.
- R-плазмиды - резистентность.
- Hly-плазмиды - гемолизины
- Ent-плазмиды - энтеротоксины
- Плазмиды бактериоциногении кодируют синтез бактериоцинов — белковых продуктов, вызывающих гибель бактерий того же или близких видов
- Плазмиды патогенности контролируют вирулентные свойства многих видов, особенно энтеробактерий
- Скрытые (криптические) плазмиды плазмиды не содержат генов, которые можно было бы обнаружить по их фенотипическому проявлению. Плазмиды бывают трансмиссивные и нетрасмиссивные. Трансмиссивные плазмиды (F-плазмиды) более крупные и наряду с генетической областью, контролирующей их репликацию, содержат также так называемую tra-область (tra-оперон). Эта область определяет способность клетки быть генетическим донором, т.е. вступать в конъюгацию с клеткой-реципиентом и передавать ей свой генетический материал (плазмидную либо хромосомную ДНК). Под контролем tra-генов синтезируются F-пили клетки-донора, необходимые для ее конъюгации с клеткой-реципиентом, а также ферменты, обеспечивающие метаболизм ДНК в процессе конъюгации.
44. Коньюгация(К)
непосредственный контакт между кл. бактерий, сопровождаемый переносом ген. материала из кл. донора в кл. реципиента.
К у бакт. Escherihia coll была открыта в 1946 г. Дж. Ледер-бергом и Е. Тэйту-мом на осн. генетич. подхода. Классические принципы при обнаружении полового процесса у любых микроорганизмов:1. Необходимо работать со штаммами одного вида бакт 2. След. учит. различия по нескол. стабильным признакам. 3. Для получ гибридов или рекомбинантов необх. применять метод селективных сред, для того чтобы регистрировать даже очень редкие события.
Взяли два штамма Е. coli, маркированные несколькими мутациями ауксотрофности:
(thr leu thi + + и + + + bio met). 1-ый нужд. в thr, leu… Восстановление прототрофности по отдельным признакам, наблюдали с частотой около 1 X 10-7=>штаммы могли бы ревертировать к дик. типу, т. е. к полной прототрофности с частотой 1- 10-14—1 •10-21, если реверсии независимы.
Штаммы смешали в жид. полноцен. сред. Смесь высеяли на min среду. Прототрофы появились с частотой 1 •10-7, что превосх. частоту спонтанного ревертирования. => эфф. обусловлен именно совместным инкубированием двух штаммов и явл. каким-то вариант. пол. процесса.
Необходимо было выяснить, не трансформация? Обработка 1-ого штамма фильтратом среды, в кот. выращивали др., не приводила к появлен. прототрофов, так же как и выращивание двух штаммов в разных отсеках-U образной трубки, разделенной посередине бактериальным фильтром. Эффект только при непосредствен. контакте бакт. и не подавлялся ДНКазой.
Перенос генетического материала от донора к реципиенту. В 1952 г. У. Хейс провел реципрокные скрещивания между штаммами Е. coli, устойчивыми и чувствительными к стрептомицину (Strr и Strs):I StrS thr leu thi + + X Stfr + + + bio met и II Stfr thr leu thi + + X StrS + + + bio met
Для учета рекомбинантов смесь кл. высевали на 2 среды: со стрептомицином и без него. 1 скрещ- только на среде без стрептомиц., 2-ое на 2 средах. => для образ рекомбинантов необх. сохранение клеток родителя: thr leu thi + +, кот. обозначили как женский (F-), а штамм + + + bio met — как мужской (F+).
Рекомбинация происходит в клетках F- — реципиентах, а клетки F+ — доноры — передают генетический материал в клетки F-. Клетки F- круглые, a F+ — продолговатые. Изолируя кл после ко коньюг., удалось показать, что только в потомстве бакт. F- появляются рекомбинанты.
45. Генетический код и его свойства
Генети́ческий код — свойственный всем живым организмам способ кодирования аминокислотной последовательности белков при помощи последовательности нуклеотидов.
Триплетность — значащей единицей кода является сочетание трёх нуклеотидов (триплет, или кодон).
Непрерывность — между триплетами нет знаков препинания, то есть информация считывается непрерывно.
Неперекрываемость — один и тот же нуклеотид не может входить одновременно в состав двух или более триплетов. (Не соблюдается для некоторых перекрывающихся генов вирусов, митохондрий и бактерий, которые кодируют несколько белков, считывающихся со сдвигом рамки).
Однозначность (специфичность) — определённый кодон соответствует только одной аминокислоте. (Свойство не является универсальным. Кодон UGA у Euplotes crassus кодирует две аминокислоты — цистеин и селеноцистеин)[1]
Вырожденность (избыточность) — одной и той же аминокислоте может соответствовать несколько кодонов.
Универсальность — генетический код работает одинаково в организмах разного уровня сложности — от вирусов до человека (на этом основаны методы генной инженерии) (Из этого свойства также есть ряд исключений, см. таблицу в разделе «Вариации стандартного генетического кода» в данной статье).
Помехоустойчивость — мутации замен нуклеотидов не приводящие к смене класса кодируемой аминокислоты, называют консервативными. Мутации замен нуклеотидов, приводящие к смене класса кодируемой аминокислоты, называют радикальными.
Ф.Крик – гипотеза последовательности – посл-ть эл-тов гена опред. посл-ть АК-ост. в полипепт. цепи. Код триплетен. 4пары осн-й – 4 АК. Если 1АК – 2 пары осн-й, томожно закодировать 16 АК, 1 АК-3 пары – 64 кодона.
Ф. Крик: код триплетен; между кодонами нет «запятых», т.е. разделяющих знаков; считывание кода в пределах гена происходит с фиксированной точки в одном направлении. Код неперекрывающийся, т.к. 1 мутация приводит к замене 1АК. Код вырожден.
Во многих случаях для кодирования АК существенны две первые позиции кодона. Для восьми АК замена осн-й в третьем положениикодона будет нейтральной: не приведет к замене АК в белке. А в тех случаях, когда это все же произойдет, такая замена не изменит свойства полярности АК. Эти особенности кода, по-видимому, отражают его эволюцию.
Все кодоны опознаются антикодонами тРНК, за искл. трех нонсенсов, или бессмысленн. кодонов, они предст. собой знаки терминации трансляции (UAA, UAG, UGA).
46.. Генетические и биохимические доказательства триплетности генетического кода.
Эксперимент. док-ва тирплетности кода еще Криком в 1961г. Исп. систему rll фага Т4 и профлавина (производное акридина) в качестве мутагена. Акридин внедряется между осн-ями ДНК, увеличивая расстояние между сосед. осн-ями в 2 раза: с 0.34 до 0.7 нм. Далее такая исскуств. удлиненная ДНК вступает в неравный кроссинговер с интактной мол-лой, в рез-те обр-ся мол-лы с лишней парой осн-й или с делецией пары осн-й.
В кач-ве исход. мутанта Крик использ. мутант FCO, индуцированный профлавином и несущий изменения в левой части гена rll B фага Т4. В рез-те спонтанного ревертирования мутанта FCO были получены ревертанты, способные образовывать негативные колонии на штамме E.coli K12. Больш-во этих мут. имели промежуточный фенотип между диким (r+) и мутантным (r). Генет. анализ показал, что ревертанты возникли за счет внутригенных супрессорных мутаций, т.е. повторных мутаций того же гена (rll B). При срещ-ии с фагом д.т. каждый псевдодикий ревертант выщеплял два класса рекомбинантов типа rll. Один нес исходную мутацию FCO, другой – мутации, к-рые супрессировали FCO, но сами по себе тоже приводили к появлению фенотипа rll.
Далее у этих рекомбинантов, неущих только супрессор. мут-ии, вновь получили рев-ты псевдодик. типа, тоже супрессор. Новые внутриген. супрессоры втор. порядка отдел. от супрессор. перв. пор., убедились в том, что они тоже приводят к возник-ю мутант. фенотипа, и с двумя из них повтор. процедуру еще раз. В рез-те – 80 независимых мутаций rll, к-рые – супрессоры мут-ии FCO или супр. супр-в этой мут-ии или супр. супр-в мут-ии FCO.
Не знали, была ли мут-я рез-том вставки или вып-я осн-й. Условно ей приписали знак “+” , супр-м перв. пор. – знак “-“, втор. пор. – “+”, супр. третьего пор. – “-“. Теперь путем рекомбинации стали объдин. их в одном гене. Оказалось, что при объединении трех мут-ий одинак. знака были получ. фаги псевдодик. типа. Получ. рез-ты подтверд. исходные предположения. Так,если предст. посл-ть пар осн-й: …ABC ABC ABC ABC ABC ABC ABC …
считываемая слева направо – участог гена rll, то втсавка лишней пары осн-й исказит записанную информацию вследствие сдвига рамки гипотетического читающего устройства:
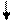 A
A
… ABC AAB CAB CAB CAB CAB CAB C…
Если выпадет пара осн-й вблизи вставки (слева или справа), то за пределами уч., огранич. вставкой или выпадением (прямой мут-й или супр-м) нуклеот. пар, исход. инф-я будет восст. Благодаря сдвигу рамки( сдвигу считывания) в обратн. напр-ии:
A B
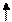 | |||
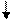 | |||
… ABC AAB CAB CAC ABC ABC ABC…
Очевидно, такое восст-е прежней записи невозм. при двух последоват. втсавках или двух последоват. выпадениях. В то же время три вставки и три вып-я должны нормализовать запись за пред. уч., огранич. крайними мут-ями:
A B C
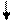 | 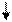 | 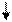 |
… ABC AAB CAB BCA BCC ABC ABC ABC
или

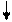
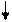 … ABC BCA BCA CAB ABC ABC
… ABC BCA BCA CAB ABC ABC
A B C
Все подобные рассуждения осн. на том, что ген rllB кодирует белок, что позже док. Кроме того все рассм. взаим-я между мут-ями могли быть только при усл., что левая частьгена может изм-ся без особых нарушений функций генного продукта. Сейчас обнар. в генах ибелках уч., допускающие вариации по составу.
Код неперекрывающийся, т.к. 1 мутация приводит к замене 1АК.
Если бы код не был вырожденным, между вставкой и выпадением с большой вероятностью должны были возникать бессмысленные триплеты, и тогда нормальное считывание было бы невозможно.
Биохимические. (Ниренберг – бесклеточные системы)
1. Добавив синтетическую полиуридиловую РНК (полиU) в бесклет. сист., приготовленную из E.coli, обнаружили, что полиU стимулирует включение в полипептид только одного типа АК ост. – Фен. Таким обр., учитывая триплетность кода, кодон для Фен был расшифрован как UUU в иРНК. Стали исп. этот способ для разных нуклеотидов, выяснили состав, но не последовательность.
2. Г. Коран: метод хим. синтеза ДНК-подобных полимеров с заданной посл-ю нуклеотидов – матрица для синтеза РНК – при помощи ДНК-завис. РНК-полимеразы пол. РНК с заранее известной посл-ю и исп. в бескл. сист. синтеза белка.
3. Ниренберг и Ледер: исп. то, что промеж. пр-ты в синтезе белка – АК, связ. с тРНК. Одного тринуклеотида на рибосоме достаточно для связывания и с рибосомой, и с тРНК.
47. Свойства нуклеиновых кислот, определяющиее их генетические функции.
информативность - специфическая последовательность четырех нуклеотидов в полинуклеотидной цепи
точность полуконсервативный механизм репликации ДНК
стабильность – двуспиральная структура, способность к самовоспроизведению (репликации)
пластичность
мутационная изменчивость -> новые признаки
рекомбинационная изменчивость - механизмы обмена генетическим материалом, принадлежащим разным особям, "по горизонтали", и возникновение на базе этого особей с рекомбинантным геномом. При генетических рекомбинациях новых генов в генофонде, как правило, не появляется. В результате ген рекомб обеспечивается возможность объединения разных генов и создание разных вариантов генных сочетаний в геноме
видовая специфичность состава ДНК (нач 50-х гг) Э. Чаргафф показал, что соотношения 4 сортов ее мономеров - G, А, С и Т - различ у разн видов орг-мов
Репликация ДНК Принципы репликации
Комплементарность. Каждая из двух цепей "материнской" молекулы ДНК служит матрицей для синтеза дополняющей её, т.е. комплементарной "дочерней" цепи
Полуконсервативность.В результате репликации образуются две двойные "дочерние" спирали, каждая из которых сохраняет (консервирует) в неизменном виде одну из половин "материнской" ДНК.
Антипараллельность и униполярность. Две комплементарные цепи в молекуле ДНК ориентированы в противоположных направлениях - антипараллельно. При этом синтез комплементарных нитей всегда ведётся в 3' направлении, то есть униполярно. Поэтому в процессе репликации одновременный синтез новых цепей идёт антипараллельно
Прерывистость. репликация начинается одновременно в нескольких местах молекулы ДНК. Участок между двумя точками, в которых начинается синтез "дочерних" цепей, называется репликоном. В эукариотической клетке в каждой молекуле ДНК имеются в зависимости от размеров сотни и даже тысячи репликонов, в которых можно видеть "репликативную вилку". Ведут синтез два по разному организованных репликативных ферментативных комплекса. Одна "дочерняя" цепь (лидирующая) растёт непрерывно, а другая (отстающая) - в виде "фрагментов Оказаки". Механизм синтеза "дочерних" цепей ДНК фрагментами называют прерывистым.
Потребность в затравке. Его синтезирует особая РНК-полимераза, называемая праймазой.
48. Генетический контроль и энзимология процесса репликации ДНК. События в репликативной вилке.
Ошибки репликации возникают из-за возможности существования оснований ДНК в неск таутомерных формах. Спонтанная мутабильность повышается в результате мутационного изменения генов, контролирующих репликацию ДНК. Ген-мутатор: мутация гена 43 (контролир репликативн ДНК-полимеразу, которая обладает двумя активностями: 5-3-полимеразной и 3-5-экзонуклеазной(последняя – функции коррекции при репликации)) бактериофага Т4 (Дж Спейсер, 1965г) -> повыш частота мутаций в гене rII, контролир скорость лизиса. Ген-антимутатор: также мутация гена 43 фага Т4 -> понижен мутагенез под действием 2-аминопурина: антимутаторная ДНК-полимераза включает меньше 2-аминоурина в ДНК, чем полимераза дикого типа или мутаторная. Т.о. частота ошибок репликации зависит от соотношения полимеразной и экзонуклеазной активности ДНК-полимеразы. Мутаторную и антимутаторную активность проявляют также и аллели других генов, контролирующих репликацию: гены, кодир ДНК-лигазу, ДНК-связ белки и др. Также есть данные о мутат активности гена dnaE, контролир ДНК-полимеразу у E.coli, а также обнаружение мутагенной ДНК-полимеразы в клетках человека, больного лейкемией. Мутаген, действующий непосредственно в репликативной вилке: N-метил-N-нитро-N-нитрозогуанидин (МННГ), который взаимодействует с одноцепочечными участками в вилке или действует на белки реплисомы.
Процесс репликации ДНК согласован с клеточным делением и требует совместного действия многих белков. В нем участвуют:
1. ДНК-хеликаза и дестабилизирующие белки; они расплетают двойную спираль родительской ДНК и формируют репликационную вилку.
2. ДНК-полимеразы, которые катализируют синтез полинуклеотидной цепи ДНК в направлении 3'-5, копируя в репликационной вилке матрицу с высокой степенью точности. Поскольку две цепи двойной спирали ДНК антипараллельны, в направлении 5'-3' непрерывно синтезируется лишь одна из двух цепей, ведущая; другая цепь, отстающая, синтезируется в виде коротких фрагментов Оказаки. ДНК-полимераза способна к исправлению собственных ошибок, но не может самостоятельно начать синтез новой цепи.
3. ДНК-праймаза, которая катализирует короткие молекулы РНК-затравки. Впоследствии фрагменты РНК удаляются - их заменяет ДНК.
4. ДНК-топоизомеразы, помогающие решить проблемы кручения и спутывания спирали ДНК.
5. Инициаторные белки, связывающиеся в точке начала репликации и способствующие образованию нового репликационного глазка с одной или двумя вилками. В каждой из вилок вслед за инициаторными белками к расплетенной ДНК сначала присоединяется белковый комплекс, состоящий из ДНК-хеликазы и ДНК-праймазы (праймосома). Затем к праймосоме добавляются другие белки и возникает "репликационная машина", которая и осуществляет синтез ДНК.
6. РНК-полимеразы, кодир геном dna G – инциация репликации.
Спираль расплетается ДНК-хеликазой; этому процессу помогают ДНК-топоизомераза, раскручивающая цепи ДНК, и множество молекул дестабилизирующего белка, связывающихся с обеими одиночными цепями ДНК. В области вилки действуют две ДНК-полимеразы - на ведущей и отстающей цепи. На ведущей цепи ДНК-полимераза работает непрерывно, а на отстающей фермент время от времени прерывает и вновь возобновляет свою работу, используя короткие РНК-затравки, синтезируемые ДНК-праймазой. Молекула ДНК-праймазы непосредственно связана с ДНК-хеликазой, образуя структуру, называемую праймосомой. Праймосома движется в направлении раскрывания репликационной вилки и по ходу движения синтезирует РНК-затравку для фрагментов Оказаки. В этом же направлении движется ДНК-полимераза ведущей цепи и, хотя на первый взгляд это трудно представить, ДНК-полимераза отстающей цепи. Для этого последняя накладывает цепь ДНК, которая служит ей матрицей, саму на себя, что и обеспечивает разворот ДНК-полимеразы отстающей цепи на 180 градусов. Согласованное движение двух ДНК-полимераз обеспечивает координированную репликацию обеих нитей.
События в репликативной вилки Е. Coli: присоединение к хромосоме белка DnaA – разделение цепей и работа геликахы. Гираза решает топологические проблемы, связанные с разделением цепей двойной спирали. С образовавшейя одноцепочечной ДНК связываются белки SSB, стабилизирующие вилку репликации. Праймаза – синтезирует РНК-праймеры на лидирующей и отстающей цепях. У сайта начала реплиации много АТ пар.
Инициация репликации у дрожжей: G1 – формирование пре-репликационного комплекса, в состав которого входят шесть белков комплекса ORC и белки Cdc6 и Mcm. При переходе к статдии S frlbdyjcnm Cdk1 возрастает и Cdc6p покидает комплекс, на его место встаёт Cdc45& После инициации репликации комплекс превращается в пост-репликационный, он состоит только из белков ORC, связв=анных с хроматином. Этот комплекс сохраняется до конца митоза, когда активность Cdk1 падает. Разделение двойной спирали происходит с помощью ДНК-геликазы и репликационного белка RPA. Репликационный белок A связывается с одноцепочечной ДНК, затем альфа-ДНК-полимераза-праймаза синтезирует короткие РНК-праймере на лидирующей и отстающей цепях, поссле чего происходит замена полимеразного комплекса на комплекс дельта-ДНК-полимеразы.
Синтез новых цепей ДНК осуществляется ДНК-полимеразами. ДНК-лигазы сшивают фрагменты оказаки.
49.Повреждения днк
Алкилирование (метилазе Dam), пиримидиновый димер и 6-4-фотопродукт (UV), одно- и двунитевой разрыв (γ-, X-rays), 8-оксигуанин (АФК), АП-сайт (гидролиз N-гликозидной связи), межнитевая сшивка (от митомицина C, азотистого иприта), сшивка ДНК-белок, ошибка спаривания (A-C, T-G и т. д.), дезаминирование оснований.
Следствия: запуск системы репарации – эксцизионная репарация, репарация неспаренных оснований (Mismatch repair – MMR), пострепликативная рекомбинационная репарация. Если репарация не помогла, запускается SOS-репарация, которая ошибается. При низкой активности репаративных механизмов повреждения ДНК приводят к мутациям.
50. Мутагенез, вызванный химическими агентами аналогами оснований, интеркалирующими агентами, алкилирующими агентами, активными формами кислорода.
Нарушения: ковалентные сшивки двух близко расположенных оснований, ковалетное связывание азотистых оснований с алифатическими и ароматическими радикалами; химические перестройки азотистых оснований, нарушения свхврофосфатного каркаса.
Алкилирующие агенты – переносят алкилирующие группы на биологические макромолекулы. Этиленимины, алкилалкансульфаноаты, эпоксиды, многоатомные спирты, производные нитрозомочевины и аминоимидазола. Транзиции – основной тип изменений под действием алкилирущиах агентов.
Аналоги онований – более высокая способность к таутомерным переходам, так же повышают чувствительность к другим мутагенам.
Акридиновые красители – мутации типа рамки считывания.внедряются между соседними оснвоаниями ДНК – либо редупликация с новым основанием, либо ошибка в репарации и рекомбинации.
Экзогенные ДНК – формирование множетства видимых и летальных перестроек – генные мутации, делеции. Очень пролонгированный эффект.
51. Мутагенез, вызванный физическими мутагенами – Ионизирующим излучением, УФ-излучением.
Ионизирующее излучение – электромагнитные рентгеновские, гамма и космические лучи, а так же высокоэнергетические альфа, бета и другие корпускулярные излучния. Выбивают электроны из внешней оболочки атомом или молекул, превращая их в положительные ионы, освобожившиеся электрны выбивают электроны из других атомов и молекул.Аомы, захватившие такие электроны, приобретают -.
Разрывается углеродно-фосфатный скелет ДНК, разрушаются основания (особенно пиримидиновые), происходят химические перестройки оснований, изменяющие способность к спариванию (например, производное пурина спар с пурином). Образуются сшивки как в молекулах нуклеиновых кислот, так и между молекулами ДНК и белками.
Уф-лучине действуют на половые клетки, проникают в ткани очень слабо, не облаают достаточной энергией для индукции ионизации атомов и только возбудлают электронные оболочки. Сутации в клетках, образующих монослой. Возникают пиримидин-пиримидиновые димеры, так же под действием УФ-облучения эти димеры разрушаются. Присутствие диеров приводит к ошибкам при репликации.
52.
Ошибки процесса репликации ДНК в клетках здорового человека происходят с частотой ~10-9-10-10 на 1 нуклеотид ДНК на 1 клеточное поколение.
В каждой клетке при температуре тела человека от ДНК отрываются >10000 оснований (в основном пуриновых) вследствие разрывов N-гликозидных связей между основанием и дезоксирибозой.
Частота спонтанных реакций дезаминирования цитозина в урацил – более 100 на клетку за сутки.
В ходе репликации ДНК, транскрипции и других процессов постоянно рвутся цепи ДНК. И это только часть реакций деструкции ДНК, происходящих в нормальной клетке в обычных условиях.
В то же время частота фиксированных наследственных изменений – мутаций генов несравнимо ниже частоты повреждений ДНК.
Менее 1 повреждения ДНК из 1000 превращается в мутацию. Этот факт объясняется работой систем репарации повреждений в ДНК.
Мутаторы – гены, повышающие частоту возникновения мутаций, антимутаторы – понижающие эту частоту (dam, mutH, mutL, mutS, mutU). Антимутаторными могут быть гены, кодирующие ферменты репликации, например, при мутации в полимеразном домене ДНК-полимераз. Мутаторными могут быть гены с мутацией в репаративном домене ДНК-полимеразы I.
Скорость репликации бактериальной хромосомы составляет около 1000 п.н./секунду. Скорость репликации у эукариот (млекопитающие) составляет около 100 п.н./с.
Прежде, чем начать репликацию необходимо расплести ДНК. Это расплетание осуществляется специальным инициаторным белком DnaA. Сайты связывания этого белка находятся в ориджине. Кроме белка DnaA в раскрытии ДНК принимают участие и другие белки (FIS, HU, HIF).
С помощью этих инициаторных белков на ДНК садится ДНК-хеликаза DnaB/DnaC (оба белка – гексамеры). Хеликаза двигается по ДНК и разрывает водородные связи между комплементарными основаниями, разделяет цепи и продвигает репликационную вилку. С однонитевыми участками ДНК связывается белок SSB. Это дестабилизирующий ДНК белок, он полностью покрывает однонитевые участки и предотвращает восстановление дуплекса.
ДНК закручена в спираль, поэтому при продвижении репликационной вилки еще не удвоенная часть ДНК должна вращаться с большой скоростью. Эта топологическая проблема решается с помощью ДНК-топоизомераз, которые способны делать в цепях разрывы, менять скрученность ДНК, а потом зашивать эти разрывы, которые раскручивают ДНК впереди репликационной вилки. Топоизомераза I релаксирует суперскрученную ДНК, делая разрыв в одной цепи и протягивая вторую цепь через этот разрыв, и зашивает разрыв. Топоизомераза II, к которой относится ДНК-гираза, делает двунитевой разрыв.
ДНК-полимеразы не могут начинать синтез ДНК на матрице, а способны лишь добавлять новые дезоксирибонуклеотиды к 3'- концу уже имеющейся цепи. Т.е. синтез ДНК на матрице должен быть инициирован коротким олигонуклеотидом, который формирует участок двунитевой ДНК. Такие короткие олигонуклеотиды называются затравками или праймерами. Праймаза (DnaG) образует комплекс с матричной ДНК и дополнительными белками, такими как DnaB, DnaT, PriA, PriB, PriC – это инициирующий комплекс или праймосома, которая синтезирует РНК-праймер.
Все ДНК-полимеразы способны синтезировать новую цепь только в одном направлении- 5'-3'. Синтез ДНК осуществляется непрерывно только на одной нити, называемой ведущей (ДНК-полимераза III). На второй нити, называемой отстающей, ДНК синтезируется короткими (длиной от 100 до 1000 нуклеотидов) фрагментами, названными фрагментами Оказаки по имени обнаружившего их ученого. Таким образом, одна из нитей синтезируется в направлении, противоположном направлению передвижения вилки.
Синтез фрагмента Оказаки терминируется перед началом РНК-праймера предыдущего фрагмента. Здесь начинает работать ДНК-полимераза I. Ее 5’-3’-экзонуклеазная активность удаляет РНК-затравку, и одновременно достраивает предыдущий фрагмент ДНК. Затем два состыкованных фрагмента Оказаки соединяются между собой ДНК-лигазой.
54. Репарация ДНК и мутационный процесс
Мутации некоторых генов, ответственных за репарацию у Е. coli,бактериофага Т4, дрожжей, а также в клетках высших эукариот, проявляют мутаторный или антимутаторный эффект, подобно мутациям в генах, ответственных за репликативный комплекс.
Наиболее подробно участие процессов репарации в возникновении мутаций исследовано у бактерии Е. coli. Показано, что мутация в гене uvr E, контролирующем ликвидацию однонитевых разрывов после ультрафиолетового (но не ионизирующего) облучения, повышает спонтанное возникновение транзиций AT - GC в 350—400 раз, а транзиций GC- АТ в 150—200 раз. Она повышает также частоту мутаций, индуцированных ультрафиолетовым светом и метилметансульфонатом.
Изучение генетического контроля репарации (а также рекомбинации) позволило доказать участие некоторых нормальных процессов, происходящих в клетке, в превращении предмутационных изменений ДНК в мутации. В частности, оказалось, что процесс становления мутаций может быть генетически блокирован так же, как любой другой физиологический процесс. Так, изменение генов lex А или rеc А ведет к частичному или полному подавлению мутационного процесса под действием ультрафиолетового света, ионизирующих излучений и некоторых химических мутагенов.
Э. Виткин обратила внимание на связь нескольких явлений, для которых общей причиной служит облучение клеток ультрафиолетовым светом: 1) индукция профага лямбда; 2) повышение выживаемости облученного бактериофага лямбда при заражении им предварительно облученных клеток Е. coli по сравнению с выживаемостью в необлученных клетках — так называемая W-реактивация, открытая Дж. Уэйглом; 3) блокирование клеточных делений у некоторых мутантов Е. coli, в результате чего клетки приобретают нитевидную форму; 4) повышение частоты рекомбинации; 5) повышение частоты мутаций.
Оказалось, что W-реактивация бактериофага сопровождается повышением его мутабильности. Кроме того, явление W-реактива-ции так же зависит от дозы ультрафиолетового света, как и индукция профага лямбда. Для осуществления обоих процессов требуется нормальное состояние генов rec A+ и lex А +. У мутантов rес А и lex А они подавлены, как и образование нитей, не говоря уже о мутагенезе, индуцированном ультрафиолетовым светом.
Параллелизм в проявлении индукции профага и W-реактивации (сопровождаемой повышением мутабильности) указывает на существование индуцируемой системы репарации, которая в связи с этим получила наименование SOS-репарации, т. е. репарации, включаемой для спасения. Индуцибельная система репарации действует по механизму пострепликативной репарации. На это указывает ее зависимость от гена rеc А. SOS-репарация включается в тех случаях, когда «безошибочная» дорепликативная система репарации не справляется с устранением повреждений или когда она блокирована мутационным путем. Для индукции системы SOS-репарации требуется 30—60 димеров тимина на геномЕ. coli. Сигналом индукции служит задержка репликации, которая при этом наблюдается.
Связь репарации и мутационного процесса показана для Drosophila melanogaster. Так, при действии кофеина на недокармливаемых мух наблюдается четкий антимутагенный эффект, судя по критерию спонтанных потерь Х-хромосомы. Известен мутатор ти у дрозофилы, в присутствии которого мухи проявляют повышенную чувствительность к рентгеновым лучам и метилметансульфонату. Мутатор ти находится в непосредственной близости к мутации С (3) G, блокирующей мейотическую рекомбинацию.
| bio |

|

Рис. 9.8. Схема интеграции и эксцизии генома бактериофага γ за счет
сайт-специфической рекомбинации с хромосомой Е. coli и образование
трансдуцирующих частиц
вопрос 55
Mismatch repair – MMR. С неправильным основанием связывается белок MutS, с которым затем связываются белок MutL. Это событие активирует латентную эндонуклеазу MutH. Образуется репарационный комплекс с затратой 1 молекулы АТР.
Белок MutH разрезает неметилированную нить ДНК по сайту GATC, который может располагаться по любую сторону от неправильного основания.
Затем ДНК-хеликаза II (MutU = UvrD) расплетает надрезанную нить ДНК между надрезом и неспаренным основанием (включая его) и вытесняет ее из гетеродуплекса.
Экзонуклеаза I (если это 3'-конец) или экзонуклеаза VII (если это 5'-конец) гидролизует вытесненную нить. Этот процесс нуждается в MutL и MutS. Вырезаются фрагменты порядка 1000 н.
Затем образовавшаяся брешь застраивается ДНК-полимеразой III в присутствии белка SSB. В завершение, ДНК-лигаза восстанавливает фосфодиэфирную связь.
Система MMR у эукариот организована сложнее функционирует эффективнее по сравнению с бактериями. У эукариот MMR исправляет все некомплементарные пары оснований и, кроме того, репарирует делеции или инсерции размером до 12 н. У бактерий MMR неспособна исправлять пары С*С и репарирует делеции/инсерции не более 3 н. Ключевые белки MMR – MutL и MutS высококонсервативны, их гомологи обнаружены у всех организмов от E.coli до человека.
56. Репарация ДНК
Удивительная стабильность генетического материала — ДНК связана отнюдь не с ее консервативностью, а с существованием в клетках всех живых организмов специальных систем репарации, устраняющих из ДНК возникающие в ней повреждения.
Явление репарации, или восстановления жизнеспособности клетки, после действия на нее гамма- и рентгеновых лучей было открыто в 1958 г. В. И. Корогодиным у диплоидных дрожжей. Повреждения ДНК, возникающие при действии излучений и химических агентов, в конечном счете приводят к нарушению регулярной Уотсон-Криковской структуры, что выражается в локальной денатурации молекулы и приводят к частичному или полному блокированию репликации. Именно такие нарушения конформации, а не конкретные изменения мономеров служат мишенью для большинства систем репарации ДНК. Существует несколько систем, осущ.репарацию. В каждую входит 4 типа ферментов:1й – узнающий «неправильный»участок и разрывающий цепь вблизи него, 2й – удал.повр.участок,3й-днк-полимераза,4й-днк-лигаза. В заав от типа повреждений меняются 1й и 2й фермент. У бактерий имеются по крайней мере 2 ферментные системы, ведущие Р. Первая осуществляет вырезание и ресинтез на небольшом участке в 5—7 нуклеотидов, вторая — на участке в тысячу нуклеотидов и более. Ферменты второй системы Р. участвуют также в процессах генетической рекомбинации. В случае повреждений, вызванных, например, УФ-светом, нормальная клетка кишечной палочки способна репарировать до 2000 повреждений; клетка с выведенной из строя первой системой Р. — около 100 повреждений; клетка с выведенными из строя обеими системами Р. погибает от одного повреждения. Существуют бактерии с исключительно активными ферментами Р. (например, Micrococcus radiodurans), которые благодаря этому способны выживать в воде, охлаждающей ядерные реакторы.
Ферментные системы Р., как полагают, принимают участие и в нормальной репликации ДНК, т. е. её удвоении. При репликации материнская ДНК деспирализуется (раскручивается), что может сопровождаться разрывами её нитей. Кроме того, дочерние цепи ДНК синтезируются в виде небольших фрагментов. Поэтому заключительная фаза репликации — Р. всех дефектов, возникших при синтезе ДНК. Важная функция второй системы Р. — её участие в образовании мутаций . Под действием различных мутагенов в ДНК образуются производные нуклеотидов, чуждые клетке. Они устраняются системой Р., которая заменяет их на нуклеотиды, естественные для ДНК, но иногда измененные по сравнению с первоначальными. Открытие Р. ДНК привело к коренным изменениям представлений о молекулярных механизмах, обеспечивающих стабильность генетического аппарата клеток и контролирующих темп мутационного процесса.
57.Репарация ДНК –фотореактивация,деалкилирование,реп.однонитевых разрывов,р.АП-сайтов.
Мутации, вызванные воздействием ультрафиолетового света, могут репарироваться благодаря явлению фотореактивации. Фотореактивация заключается в восстановлении биологической активности клеток или молекул ДНК, поврежденных ультрафиолетовым излучением в результате последующего воздействия видимого света. При фотореактивации происходит мономеризация циклобутановых димеров тимина и других пиримидиновых димеров in situ. Известна так называемая неферментативная коротковолновая фотореактивация, которая заключается в мономеризации димеров при действии ультрафиолетового света с длиной волны 240 нм, а также ферментативная фотореактивация. Именно последнюю обычно и подразумевают под собственно фотореактивацией. Фотореактивация при действии видимого света (300—400 нм — наиболее активная часть спектра) была обнаружена в 1949 г. в нескольких лабораториях. Механизм этого явления был раскрыт в начале 60-х годов нашего века после выделения К. Рупертом из клеток микроорганизмов фермента фотореактивации — дезоксирибопиримидинфотолиазы. Экстракты дрожжей оказались способными восстанавливать трансформирующую активность ДНК Haemophyllus influenzae на свету. Субстратом фермента фотореактивации служат димеры пиримидиновых оснований, с которыми он образует комплекс в темноте (с неповрежденной ДНК фермент не связывается). На свету комплекс распадается, при этом происходит мономеризация димеров. В клетке эукариот фермент локализован в ядре, у прокариот — в непосредственной близости к нуклеоиду. В частности, он не обнаруживается в безнуклеоидных миниклетках, которые образуют некоторые мутанты Е. coli. Известен мутант phr E. coli, у которого блокирована фотореактивация. При облучении видимым светом у этого мутанта не исчезают тиминовые димеры из ДНК. Фермент фотореактивации найден у примитивных микроорганизмов, как микоплазмы, у многих высших растений и животных. Фермент образует стабильный комплекс с пиримидиновым димером и используя энергию поглощенног им света разрушает димер без разрыва цепей ДНК.
Если под воздействием алкилирующих агентов - N-метил -N-нитрозомочевины или N1, N-диметилнитрозогуанидина, в ДНК образовался О6- метил- или О6-алкилзамещенные гуаниновые остатки, то деалкилирование таких остатков идет при участии ферментов - О6-метилгуанин-ДНК-алкилтрансферазы, которая катализирует перенос алкильных групп на сульфгидрильные группы цистеиновых остатков фермента, при этом акцепторный белок инактивируется. Это у бактерий и млекопитающих.
Репарация однонитевых разрывов ДНК осуществляется последовательным действием 3'-фосфодиэстеразы, ДНК-полимеразы b и ДНК-лигазы [18]. Восстановление однонитевого разрыва ДНК происходит с использованием в качестве матрицы комплиментарной цепочки ДНК. Репарация данного типа повреждений может также происходить с участием механизма эксцизионной репарации нуклеотидов.
Эксцизионная репарация осуществляется в несколько этапов. На первом этапе поврежденное основание удаляется ДНК гликозилазами, далее сахар без основания (АП-апуриновый-сайт) вырезается АП-эндонуклеазами. На втором этапе образовавшаяся брешь размером в одно основание восстанавливается до исходной последовательности с помощью совместного действия экзонуклеаз, полимеразы и ДНК лигазы
58.Эксцизионная репарация
Эксцизионную репарацию, т. е. связанную с удалением поврежденного участка ДНК, называют также репарацией по типу выщепления — замещения или более образно «механизм режь — латай». Наиболее подробно изучена именно репарация ДНК, содержащей тиминовые димеры. Появление димеров приводит к локальной денатурации ДНК, что влечет за собой нарушение процесса репликации: каждый тиминовый димер в ДНК Е. coli задерживает репликацию на 10 с.
Эксцизионная репарация представляет собой многоэтапный процесс и заключается в: 1) «узнавании» димера, 2) надрезании одной цепи ДНК вблизи димера — инцизии, 3) удалении димера — эксцизии, 4) ресинтезе ДНК и 5) восстановлении непрерывности репарируемой цепи за счет образования ковалентных связей сахарофосфатного скелета молекулы.
«Узнавание» повреждения в ДНК осуществляет фермент УФ-эндонуклеаза, который реагирует не только на димеры тимина, но и на многие другие изменения, приводящие к локальному нарушению структуры ДНК. Эндонуклеаза ответственна и за инцизию, т. е. надрезание одной цепи ДНК (разрыв фосфодиэфирных связей) непосредственно около димера с 5'-конца в поврежденной цепи. Эксперименты in vitro с облученной ДНК показали, что число однонитевых разрывов оказывается равным числу димеров в молекуле.
Эксцизию, или вырезание димера из молекулы ДНК, осуществляет другая нуклеаза. Димер удаляется в составе короткого олигонуклеотида (3—5 оснований), что может сопровождаться дальнейшей деградацией поврежденной спирали. Продукты деградации облученной ДНК, содержащие тиминовые димеры, можно обнаружить в клетках. У некоторых бактерий димеры находили и в культуральной среде. Деградацию ДНК осуществляет АТФ-зависимая ДНКаза. В результате эксцизии и последующей деградации ДНК образуются однонитевые бреши, или пробелы.
Ресинтез ДНК, в результате которого заполняются бреши, идет с использованием в качестве матрицы интактной цепи. Такой репаративный синтез ДНК напоминает «дополнительную» репликацию, обнаруженную в пахитене у эукариот.
Основной фермент, ответственный за эксцизию димеров и репаративный синтез ДНК, — это ДНК-полимераза I, кодируемая геном pоl А. Тем не менее у мутантов pol А, дефектных по ДНК-полимеразе I, все же наблюдается остаточный репаративный синтез, который связан с активностью ДНК-полимеразы II.
Известно, что неполуконсервативный синтез ДНК в 99% случаев происходит на коротких участках длиной до 30 нуклеотидов. За эту реакцию ответственна ДНК-полимераза I. В 1% случаев синтез идет на гораздо более длинных отрезках — 1000—1500 нуклеотидов
По-видимому, эту реакцию и осуществляет ДНК-полимераза II.
Последний этап эксцизионной репарации заключается в восстановлении непрерывности репарируемой цепи ДНК с помощью фермента ДНК-лигазы, кодируемого геном lig E. coli. Температурочувствительные мутанты по этому гену не способны не только завершать процесс эксцизионной репарации в непермиссивных условиях, но и накапливают фрагменты Оказаки при репликации ДНК.
59. Неспаренные основания в ДНК могут возникать в результате трех событий:
1) прямого повреждения оснований ДНК или их предшественников продуктами клеточного метаболизма;
2) ошибочной подстановки некомплементарного основания ДНК-полимеразой в ходе репликации
3) рекомбинационной интеграции однонитевого участка ДНК в неабсолютно идентичную ДНК, партнера по рекомбинации.
Все события приведут к образованию гетеродуплексной ДНК , которая и становится субстратом для ферментов, корректирующих неправильные пары оснований.
Процесс репарации ДНК при обнаружении ферментами неканонической пары в дуплексе ДНК проходит через ряд реакций.
Обычно такая цепь реакций начинается с обнаружения и удаления одного из нуклеиновых оснований неканонической пары в ДНК, катализируемого соответствующим ферментом группы AP-эндонуклеаз типа II (апуриновых/апиримидиновых эндонуклеаз)
Затем происходит гидролитическое расщепление 3'-фосфоэфирной связи, причем фосфат остается в 5'-положении уходящей цепи ДНК. Далее с 3'-концом в месте расщепления цепи связывается ДНК-полимераза бета , приводящая к образованию шиффа между ферментом и 3'-цепью ДНК, катализирующая гидролитическое удаление дезоксирибозилфосфатного остатка (реакция В), таким образом освобождая 3'-конец для включения соответствующего канонической паре нуклеотида.
60.SOS-репарация относится к пострепликативной репарации.Этот тип репарации был открыт в клетках мутантов E. coli, не способных выщеплять тиминовые димеры. В таких клетках после ультрафиолетового облучения происходит репликация ДНК, хотя и медленнее, чем в клетках дикого типа. Показано, что в клетках мутантов uvr А после действия ультрафиолетового света синтезируется ДНК с однонитевыми пробелами, или брешами, причем длина вновь синтезированных фрагментов соответствует среднему расстоянию между возникшими в родительской ДНК тиминовыми димерами. Таким образом, после репликации нерепарированной ДНК против тиминовых димеров образуются бреши, которые, как оказалось, исчезают при последующей инкубации клеток в питательной среде. Этот тип репарации не происходит в клетках гес-мутантов, дефектных по рекомбинации. Поэтому постреплика-тивную репарацию называют также рекомбинационной репарацией.
Механизм пострепликативной репарации наименее специфичен,так как здесь отсутствует этап узнавания повреждения. Представления об этом типе репарации связаны со знанием механизмарекомбинации. Рекомбинационная пострепликативнаярепарация — это быстрый способ восстановления нативнойструктуры по крайней мере части дочерних молекул ДНК. При этом тиминовые димеры остаются в исходных родительских нитях. Эта репарация происходит уже в первые минуты после облучения.
Существует и другая разновидность — медленная пострепликативная репарация, для осуществления которой требуется несколько часов. Ее проводит система ферментов, которых нет в необлученных клетках и которую индуцирует облучение. Этот механизм получил наименование SOS-репарации. Его характерная черта — неточность восстановления первичной структуры ДНК, в связи с чем он получил также название репарации, склонной к ошибкам. При этом, по мнению ряда авторов, возможен репаративный синтез ДНК «в обход» тиминовых димеров, или, точнее, за счет использования в качестве матрицы цепи ДНК, содержащей димеры.
Пострепликативная репарация существует не только у бактерий, но и в клетках эукариот. Она обнаружена и у млекопитающих, для которых получены данные о том, что пострепликативные бреши могут заполняться не за счет рекомбинации, а за счет синтеза ДНК de novo. Один из типов пигментной ксеродермы у человека (XPvar) связан с блоком пострепликативной репарации.
Дата добавления: 2014-12-06; просмотров: 2723;
