Метод валентных связей
Метод ВС основан на следующих основных положениях:
а) химическая связь между двумя атомами возникает как результат перекрывания АО с образованием электронных пар (обобщенных двух электронов);
б) атомы, образующие химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами (энергия притяжения атомов) вносит свой вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц;
в) в образовании химической связи участвуют электроны с антипараллельными спинами;
г) характеристики химической связи (энергия, длина, полярность и др.) определяется типом перекрывания АО.
Электронная структура молекулы значительно отличается от электронной структуры образующих ее атомов. Например, электронные орбитали в молекуле водорода не имеют сферической симметрии в отличие от АО атома водорода, так как электронная пара принадлежит двухцентровой молекулярной системе. В то же время эта связывающая электронная пара находится на более низком энергетическом уровне, чем неспаренные электроны атомов водорода.
В результате образования молекул из атомов изменения претерпевает лишь электронная структура внешних и предвнешних оболочек атомов. Поэтому в образовавшейся молекуле атомы с исходной электронной структурой не существуют. У атомов в молекуле сохраняются лишь электронные конфигурации внутренних электронных оболочек, не перекрывающихся при образовании связей.
Способность атома присоединять или замещать определенное число других атомов с образованием химических связей называется валентностью. Согласно методу ВС, каждый атом отдает на образование общей электронной пары (ковалентной связи) по одному неспаренному электрону. Количественной мерой валентности в обменном механизме метода ВС является число неспаренных электронов у атома в основном или возбужденном состоянии. К ним относятся неспаренные электроны внешних оболочек атомов s- и р-элементов, внешних и предвнешних оболочек d-элементов.
При образовании химической связи атом может переходить в возбужденное состояние в результате разъединения пары или пар электронов и переходе одного (или нескольких электронов, равных числу разъединенных пар) на свободную орбиталь той же оболочки. Например, электронная конфигурация кальция в основном состоянии записывается как 4s2. В соответствии с обменным механизмом метода ВС валентность его равна нулю, т.е. для Са (…4s2) валентностьВ=0. У атома кальция в четвертой оболочке (п=4) имеются вакантные р-орбитали. При возбуждении атома происходит распаривание электронов и один из 4s-электронов переходит на свободную 4s-орбиталь. Валентность кальция в возбужденном состоянии равна двум, т.е. при распаривании валентность увеличивается на две единицы.
| 4s | 4p | 4s | 4p | |||||||||||||||
| Ca | ↑↓ | → | Ca* | ↑ | ↑ | B*=2 | ||||||||||||
В отличие от кислорода и фтора, электронные пары которых не могут разъединяться, т.к. на втором уровне нет других вакантных орбиталей, электронные пары серы и хлора могут распариваться, т.к. на третьем уровне есть вакантные 3d-орбитали. Соответственно сера, кроме валентности основного состояния I и II,
| 3s | 3p | 3d | ||||||||
| ↑↓ | ↑↓ | ↑ | ↑ |
имеет еще валентности IV и VI в возбужденных состояниях:
| 3s | 3p | 3d | ||||||||
| ↑↓ | ↑ | ↑ | ↑ | ↑ | ||||||
| ↑ | ↑ | ↑ | ↑ | ↑ | ↑ |
Пространственная структура молекул.
Как было показано ранее, ковалентная химическая связь характеризуется направленностью, что обусловлено определенными ориентациями АО в пространстве.
Связь, образованная перекрыванием АО по линии, соединяющей ядра соединяющихся атомов, называется σ-связью. Примерами образования σ-связей являются перекрывания s-орбиталей, s- и p-орбиталей, р-орбиталей, d-орбиталей, а также d- и s-орбиталей, d- и р-орбиталей и т.д. Некоторые из примеров σ-связей приведены ниже.
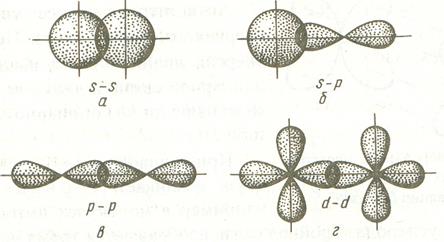
Можно видеть, что в случае σ-связей область максимальной электронной плотности находится на линии, соединяющей ядра атомов.
Связь, образованная перекрыванием АО по обе стороны от линии, соединяющей ядра атомов (боковое перекрывание), называется π-связью. π-связь может образоваться при перекрывании р-р, р-d, f-p, f-d и f-f-орбиталей. Ниже приведены примеры образования π-связей.
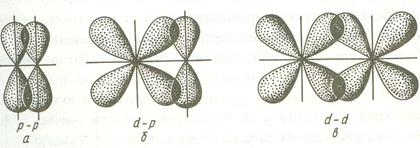
Поскольку при образовании π-связей степень перекрывания орбиталей невелика по сравнению с σ-связями, энергия этих связей существенно ниже.
При наложении π-связи на σ-связь образуется двойная связь, например, в молекулах кислорода, этилена, диоксида углерода:
 |  |

 О=О , С=С , О=С=О.
О=О , С=С , О=С=О.
При наложении двух π-связей на одну σ-связь возникает тройная связь, например, в молекулах азота, ацетилена, синильной кислоты:
 ,
, 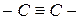 ,
, 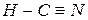 .
.
Чем выше кратность связи, тем больше ее энергия и тем меньше длина связи.
Некоторые формы соединений невозможно объяснить с точки зрения их образования из возбужденных или невозбужденных атомов. Так, в молекуле метана все связи С-Н равноценны, что противоречит набору орбиталей у возбужденных и невозбужденных форм атома углерода. Последовательное обоснование этого и других фактов найдено в рамках концепции гибридизации АО.
Гибридизация - это смешение различных по энергии и форме орбиталей атома, приводящие к образованию такого же количества одинаковых по энергии и форме гибридных орбиталей. Эквивалентность гибридных орбиталей обусловливает не только образование равноценных по энергии связей, но и одинаковые валентные углы между связями, образуемыми этими орбиталями. Следует подчеркнуть, что гибридные АО образуются у одного атома, имеющего разные орбитали, причем объектом гибридизации являются орбитали, имеющие близкие значения энергии.
В случае метана гибридизация является результатом смешения одной s- и трех р-орбиталей в возбужденном состоянии атома углерода, так называемая sp3-гибридизация.
 sp3
sp3
| 2p | 2p | ||||||||||||
| 2s | ↑ | ↑ | → | 2s | ↑ | ↑ | ↑ | → | ↑ | ↑ | ↑ | ↑ | |
| ↑↓ | ↑ |
Образование гибридных орбиталей обусловливает энергетическую выгодность образующихся посредством этих орбиталей химических соединений. Это связано с двумя факторами.
Во-первых, гибридные орбитали ассимметричны, что обусловливает большую степень перекрывания при образовании ими химических связей и большую их прочность.
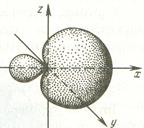
Во-вторых, валентные углы между гибридными орбиталями больше, чем негибридными, что обусловливает меньшую степень отталкивания между электронами связей, образуемых этими орбиталями, и делает молекулярные системы более стабильными.
При sp3-гибридизации продольные оси симметрии гибридных орбиталей находятся по отношению друг к другу под углом 109º28' – соответствующих их направлению к углам тетраэдра, центром которого является ядро атома.
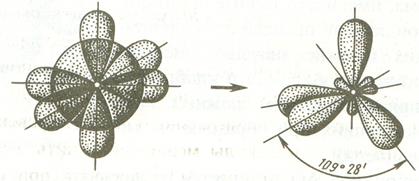
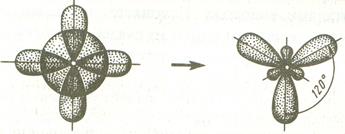
Если объектами гибридизации является одна s и две р-орбитали, то такой тип гибридизации называется sp2- гибридизация, а углы между продольными осями этих орбиталей равны 120ºС и соответствуют минимальному отталкиванию между валентными электронами.
При смешении одной s- и одной р-орбитали имеет место sp-гибридизация. В этом случае валентный угол между гибридными орбиталями составляет 180˚ С.

Пространственная структура молекул определяется числом атомов в молекуле, гибридизацией орбиталей и числом неспаренных электронов на них, ответственных за образование связей.
Молекула, образованная двумя атомами, линейна. Если на внешней оболочке атома имеется два неспаренных р-электрона, то при перекрывании их АО орбиталями других атомов, образуется угловые молекулы. К таким атомам относятся атомы р-элементов VI группы (O, S, Se, Te), электронная конфигурация внешних оболочек которых приведена ниже.
| ns | np | ||||
| ↑↓ | ↑↓ | ↑ | ↑ |
Две р-орбитали с неспаренными электронами расположены перпендикулярно друг к другу, поэтому угол в молекулах H2S, H2Se и H2Te близок к 90˚. Вследствие отталкивания электронов валентный угол между связями в молекуле H2S несколько выше 90˚. У молекул воды угол между связями значительно больше и равен 105˚. Такую структуру можно объяснить, если принять, что это происходит sp2 гибридизация АО кислорода при образовании воды. При этом две гибридные орбитали перекрываются s-орбиталями водорода. Отталкивание валентных электронов связей Н-О от неподеленных пар электронов кислорода обусловливает уменьшение валентного угла от 120о до 105˚.
Образование молекул аммиака можно представить через sp3-гибридизацию невозбужденного атома азота.
| 2p | 
| |||||||
| 2s | ↑ | ↑ | ↑ | → | ↑ | ↑ | ↑ | ↑↓ |
| ↑↓ |
невоздужденное sp3 -гибридизация
состояние атома
Три орбитали с неспаренными электронами образуют химические связи с атомами водорода, давая пирамидальную структуру, а оставшаяся неподеленная электронная пара азота, отталкивая от себя валентные электроны, понижает валентные углы с тетраэдрических (109˚28') до 108º.
Дата добавления: 2014-12-05; просмотров: 2089;
