Энергия химической связи (D) – количество энергии, которое выделяется при образовании данной химической связи из атомов.
Для многоатомных молекул с однотипными связями за энергию связи принимается среднее ее значение, рассчитанное делением энергии образования соединения из атомов на число связей. Так, поскольку энергия, поглощаемая в процессе Н2О = 2Н + О равна 924 кДж/моль, а в молекуле воды обе связи О – Н химически эквивалентны, то средняя энергия связи D(O-H) = Dдисс../2 = 924/2 = 462 кДж/моль.
Важной характеристикой химической связи является ее длина l, равная расстоянию между ядрами в соединении. Она зависит от размеров электронных оболочек и степени их перекрывания. Для однотипных видов связи имеется определенная корреляция между длиной и энергией связи: с уменьшением длины связи обычно растет энергия связи и, соответственно, устойчивость молекул. Например, для молекул галогенводородов в ряду
l(НF) < l(HCl) < l(HBr) < l(HI)
растет длина связи и уменьшается ее энергия
D(H-F) > D(HCl) > D(HBr) >D(HI).
Основными видами химической связи являются ионная, ковалентная и металлическая.
Ионная связь представляет собой электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Такая связь возникает в случае большого различия электроотрицательности атомов, участвующих в образовании связей. Подобная ситуация имеет место при образовании связей между катионами s-элементов (металлов) первой и второй групп периодической системы и анионами неметаллов VI и VII групп (LiF, CsCl, K2O и др.). Высокое различие в электроотрицательности (ЭО) атомов обусловливает практически полный переход электронов от атомов с низкой ЭО к атомам с высокой ЭО и их ионизацию. В результате доминирующий вклад в энергию связывания вносит кулоновское взаимодействие между противоположно заряженными ионами.
Ковалентной является химическая связь, образованная путем обобществления пары электронов двумя атомами. При сближении двух атомов, например, атомов хлора, происходит перекрывание их орбиталей.

Cl Cl
В результате электронная плотность между ядрами их атомов возрастает, и ядра притягиваются друг к другу. При чрезмерном сближении возрастает отталкивание ядер. Противоборство этих двух сил обусловливает энергетический минимум на потенциальной кривой взаимодействия атомов, равный энергии связи.

Этому минимуму соответствует оптимальное расстояние между ядрами, равное длине связи lсв.
Особенностями ковалентной химической связи являются ее направленность и насыщаемость.Так как атомные орбитали пространственно ориентированы, то их перекрывание происходит по определенным направлениям, что и обусловливает направленность ковалентной связи. Количественно направленность выражается в виде валентных углов между направлениями химической связи в молекулах. Насыщаемость ковалентной связи обусловлена ограничением числа электронов, участвующих в ее образовании.
Удобным параметром для описания размера атома, участвующего в образовании ковалентной связи, является ковалентный радиус rков. Его определяют для атома Х как половину длины типичной простой гомоядерной связи Х–Х.
Если ковалентная связь образуется одинаковыми атомами, например Н–Н, О=О и др., то обобществленные электроны равномерно распределены между ними. Такая связь называется ковалентной неполярной связью. Если же один из атомов обладает большей электроотрицательностью по сравнению с другим, то электронная пара смещается в сторону более электроотрицательного атома. В этом случае возникает ковалентная полярная связь. При этом чем больше разница в электроотрицательности атомов, образующих связь, тем больше полярность связи. В результате смещения электронов от одного атома к другому на одном из них (более электроотрицательном) образуется частичный отрицательной заряд ( 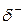 ), на другом – частичный положительный заряд (
), на другом – частичный положительный заряд ( 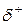 ). В результате образуется диполь – нейтральная система с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися друг от друга на расстоянии lD, называемым длиной диполя. Мерой полярности связи является электрический момент диполя
). В результате образуется диполь – нейтральная система с двумя одинаковыми по величине положительным и отрицательным зарядами, находящимися друг от друга на расстоянии lD, называемым длиной диполя. Мерой полярности связи является электрический момент диполя 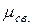 , равный произведению эффективного заряда
, равный произведению эффективного заряда 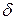 на длину диполя
на длину диполя
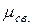 =
= 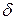 . lD.
. lD.
Полярную ковалентную связь с 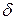 , приближающимся к 1, можно считать ионной связью. Однако даже у ионных соединений
, приближающимся к 1, можно считать ионной связью. Однако даже у ионных соединений 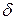 ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
ниже единицы. Поэтому любая ионная связь имеет определенную долю ковалентности.
При описании распределения электронов в молекулах используют два основных метода расчета: метод валентных связей (ВС) и метод молекулярных орбиталей (МО).
Дата добавления: 2014-12-05; просмотров: 1662;
