ФИБРОБРОНХОСКОПИЯ
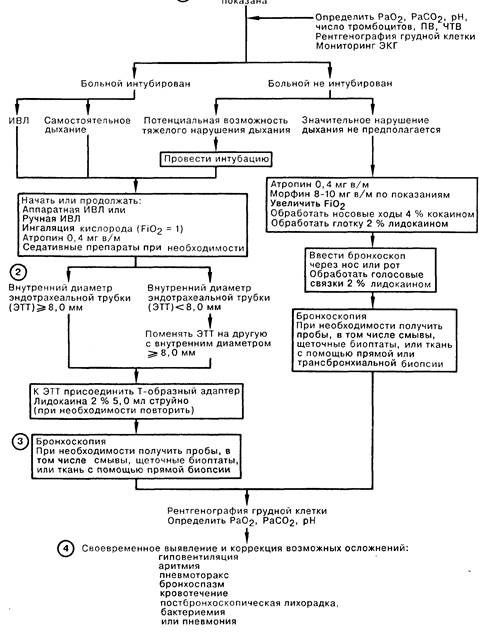
1. Общепринятым показанием к фибробронхоскопии (ФБС) у больных в отделении интенсивной терапии (ОИТ) является лечение сегментарного или долевого коллапса легкого, хотя у больных с долевым ателектазом вследствие закупорки бронха слизистой пробкой проведение ФБС не имеет преимуществ перед глубоким дыханием, покашливанием и перкуссией грудной клетки. Методом выбора ФБС может быть при лечении больных, с которыми невозможно вступить в контакт, больных с хроническим ателектазом легочной ткани, а также при неэффективности обычной дыхательной терапии. ФБС позволяет выявить присутствие инородных тел, в частности аспирированного желудочного содержимого, скрыто протекающее злокачественное новообразование, явившееся причиной коллапса. Трудности с поддержанием проходимости дыхательных путей разрешаются благодаря проведению бронхоскопа через или рядом с эндотрахеальной трубкой (ЭТТ). Причиной обструкции ЭТТ может быть засохший секрет или перераздувание манжетки. Чтобы обследовать слизистую трахею под манжеткой, следует подтянуть интубационную трубку на несколько сантиметров назад. При скоплении секрета в трахее, параличе или отеке голосовых связок у больного может наступить полная обструкция трахеи, если трахеостомическая канюля также оказывается непроходимой; эти нарушения легко выявляются бронхоскопией над трахеостомическим отверстием. Иногда бронхоскопия позволяет осуществить сложную интубацию, при этом ЭТТ проводится по введенному бронхоскопу в трахею. Причиной неожиданного кровохарканья может быть травма слизистой ЭТТ либо эндобронхиальным катетером при отсасывании секрета, а также другие, не специфические для больных в ОИТ, состояния. Массивное кровохарканье служит показанием для проведения бронхоскопии с помощью жесткого бронхоскопа ввиду необходимости интенсивного отсасывания и поддержания проходимости дыхательных путей. Бронхоскопию проводят также в диагностических целях при обнаружении в легких инфильтратов или образований.
2. Важное значение имеет размер ЭТТ, так как фибробронхоскоп занимает большую часть поперечного сечения небольшой интубационной трубки и может сильно повышать сопротивление газотоку. Обычно используемый у взрослых больных бронхоскоп приводит к обтурации 50% просвета трубки с внутренним диаметром (ВД) 8 мм, вызывая возрастание пикового давления в дыхательных путях, а также может способствовать возникновению высокого давления в конце выдоха, чрезмерного раздувания и баротравмы легких. ФБС можно проводить через ЭТТ с ВД не менее 8 мм. При необходимости ФБС может быть введен в трахею рядом с ЭТТ. Во избежание чрезмерного раздувания следует прекратить проведение ИВЛ с ПДКВ на время бронхоскопии. Интубированному больному при спонтанном дыхании следует провести аппаратную или ручную вентиляцию с помощью дыхательного мешка.
3. Можно выполнить обычную или щеточную биопсию дыхательных путей крупного калибра; для получения проб из дистальных отделов легких проводят бронхоальвеолярный лаваж, для чего герметично вводят в дистальный бронх бронхоскоп и производят струйную инсталляцию изотонического раствора с последующей эвакуацией жидкости. Результаты посевов бактериальной флоры, полученной при бронхоскопии даже с защищенной щеточкой, с трудом могут быть интерпретированы из-за контаминации самого бронхоскопа. Тем не менее диагностическое значение имеет обнаружение Pneumocystis carinii, Mycobacterium tuberculosis и других патогенных микроорганизмов. При наличии быстро увеличивающегося и мешающего дыханию легочного инфильтрата диагностическим методом выбора является открытая биопсия легкого. Больному, нуждающемуся в проведении ИВЛ с положительным давлением, нельзя выполнять трансбронхиальную биопсию ввиду высокого риска возникновения пневмоторакса.
4. Опасность при проведении ФБС, в особенности у больного во время ИВЛ, заключается в гиповентиляции вследствие разгерметизации и утечки воздуха вокруг фиброскопа, избыточном отсасывании, а также превышении верхней границы давления, на которую установлен клапан респиратора. Следует проводить постоянный контроль объема выдыхаемого воздуха. Предупредить возникновение гипоксемии можно с помощью ингаляции 100% кислорода. Причиной баротравмы может быть чрезмерное раздувание вследствие ФБС. Высокое давление на выдохе снижает венозный возврат и сердечный выброс. Следует предусмотреть возможность возникновения аритмии; наготове должнь быть средства, чтобы купировать это осложнение. На весь период процедуры больного следует подключить к кардиомонитору. Распознать бронхоспазм можно по закрытию на выдохе дыхательных путей, а также по повышению пикового давления в дыхательных путях. В этой ситуации следует прекратить введение фибробронхоскопа и ввести больному бронходилататоры. Кровотечение может произойти вследствие обычной или щеточной биопсии легкого. Больному с установленной коагулопатией перед любой биопсией следует провести инфузию тромбоцитов, свежезамороженной плазмы либо специфическую заместительную терапию.
После бронхоскопии часто возникает лихорадка, однако это состояние редко связано с бактериемией или бактериальной пневмонией.
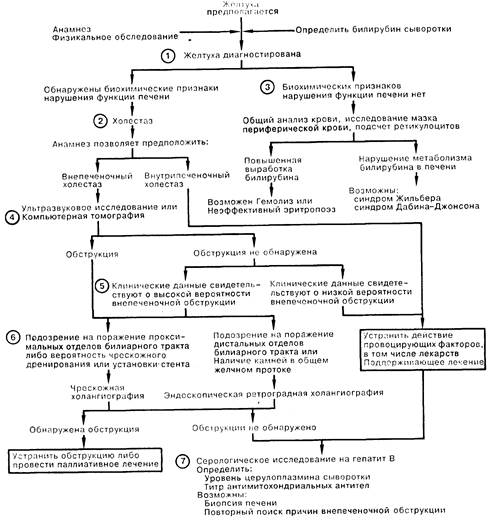
ЖЕЛТУХА. 1. Характерным признаком желтухи является необычно яркий желтый оттенок склер, слизистых покровов кожи или мочи в связи с повышением содержания билирубина в сыворотке крови более 50 мкмоль/л ( > 3 мг%). О наличии холестаза свидетельствуют некоторые клинические и биохимические показатели; они включают кожный зуд, темный цвет мочи (указывает на конъюгированную гипербилирубинемию), а также обесцвеченный стул. Биохимические показатели функции печени (повышение активности трансаминаз и щелочной фосфатазы сыворотки) подтверждают наличие холестаза. Среди других показателей следует назвать увеличение содержания в сыворотке желчных кислот, повышение активности гаммаглутамилтрансферазы, 5'-нуклеотидазы, а также лейцинаминопептидазы. Последние тесты особенно полезны в дифференциальной диагностике (поражение печени или костей) причин повышения активности щелочной фосфатазы. Определение фракций прямого или непрямого билирубина имеет ограниченное диагностическое значение.
2. При наличии холестаза необходимо быстро исключить внепеченочную обструкцию желчевыводящих путей, так как неотложная декомпрессия последних приобретает самостоятельное значение. Даже при подозрении на внутрипеченочный холестаз показано обследование желчных путей с помощью неинвазивных методов исследования. Наличие лихорадки, озноба, боли в животе, а также перенесенное оперативное вмешательство на желчных путях позволяют предположить внепеченочную обструкцию билиарного тракта.
3. Если не обнаружены биохимические сдвиги при лабораторном исследовании функции печени, следует выполнить общий анализ крови, подсчет ретикулоцитов, исследование мазка периферической крови; результаты позволяют заподозрить либо гемолиз и неэффективный эритропоэз (дефицит витамина В12 или фолиевой кислоты), либо селективный дефект транспорта билирубина (болезнь Жильбера, приводящая к неконъюгированной гипербилирубинемии; синдром Дабина—Джонсона, при котором встречается конъюгированная гипербилирубинемия).
4. При подозрении на внепеченочную обструкцию можно рекомендовать проведение обследования с помощью неинвазивных визуализирующих методик, предпочтительнее — ультразвукового исследования, как наименее дорогого и не создающего в отличие от компьютерной томографии лучевой нагрузки. Компьютерная томография чаще всего является методом выбора для определения уровня обструкции; однако следует учитывать, что ни одна из методик не обладает абсолютной информативностью для обнаружения обыкновенных желчных камней. В некоторых случаях (например, при рецидивирующей желтухе у больного после холецистэктомии) имеет смысл сразу приступить к прямой визуализации желчевыводящих путей, не прибегая к неинвазивным методам исследования билиарного тракта.
5. Ложноотрицательные результаты исследований встречаются у больных с циррозом, склерозирующим холангитом или холедохолитиазом. Если имеется подозрение на одно из этих расстройств или у врача есть основания подозревать обструкцию, следует провести прямую визуализацию протоков.
6. Выбор между чрескожной или эндоскопической ретроградной холангиопанкреатографией (ЭРХП) нередко зависит от относительной доступности каждой из этих процедур. Обе методики высокоспецифичны, чувствительны и безопасны (менее 5% осложнений) при выполнении опытным персоналом. При одинаковой доступности этих процедур предпочтение отдается ЭРХП в отсутствие дилатированных желчных протоков или подозрений на наличие желчных камней; ЭРХП также выполняют, если в ходе процедуры может потребоваться проведение эндоскопической сфинктеротомии. При необходимости наружного дренирования желчных путей и/или чрескожной дилатации для прямой холангиографии следует предпочесть чрескожный доступ.
7. Из лабораторных методов исследования для дифференциальной диагностики внутрипеченочного холестаза наибольшее значение имеют серологические тесты на наличие гепатита В, определение уровня сывороточного церулоплазмина (обычно снижен при болезни Вильсона), а также определение титра антимитохондриальных антител (положительный результат у более чем 85% больных с первичным циррозом печени на определенной стадии заболевания). Биопсия печени не показана в ходе рутинного обследования по поводу желтухи, но может быть полезна при дифференциальной диагностике в более сложных случаях внутрипечсночного холестаза. Если диагноз остается неясен, следует провести повторный анализ имеющихся данных для выявления возможной внутрипеченочной обструкции.
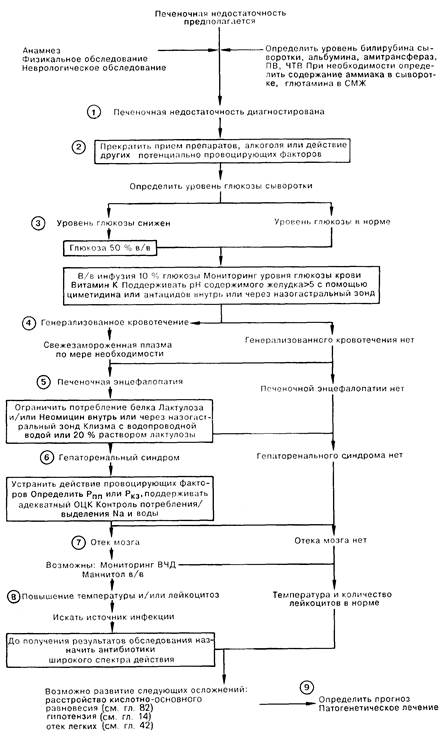
ПЕЧЕНОЧНАЯ НЕДОСТАТОЧНОСТЬ. 1. Печеночная недостаточность может наступить в результате хронического или острого заболевания печени [молниеносная печеночная недостаточность (МПН), как правило, развивается вследствие вирусного гепатита или действия гепатотоксинов и лекарственных препаратов]. Характерными чертами этого состояния являются признаки повреждения паренхимы печени (повышение уровня трансаминаз в сыворотке), признаки печеночной недостаточности (увеличение протромбинового времени, гипогликемия, гипербилирубинемия, гипоальбуминемия), а также гепатаргия (угнетение сознания, астериксис, повышение аммиака крови и уровня глутамина в СМЖ). Гепатаргию следует дифференцировать от состояний со спутанным сознанием вследствие травмы, инфекционного заболевания, отравления лекарственными препаратами, а также от метаболических расстройств, возникших на фоне заболевания печени. Некоторые расстройства (пункты 3,4,7) при МПН возникают чаще, чем при хронической печеночной недостаточности, и часто развиваются быстро и одновременно; лечение в ОИТ показано каждому больному с МПН.
2. Не существует специфической терапии при печеночной недостаточности; однако ясно, что следует прекратить прием потенциально токсичных препаратов и алкоголя. Провоцирующие факторы могут вызвать развитие осложнений, особенно у больных с хронической печеночной недостаточностью; устранение подобных факторов является важной составной частью лечения.
3. МПН часто осложняется гипогликемией. Всем больным показаны в/в инфузии 10% глюкозы; необходим постоянный динамический контроль уровня глюкозы крови, так как для поддержания нормогликемии может потребоваться инфузия более концентрированных растворов глюкозы.
4. В печени синтезируются многие факторы свертывания, поэтому у больных с печеночной недостаточностью, особенно МПН, могут наблюдаться глубокие расстройства коагуляции. Показано введение витамина К, хотя это редко приводит к ликвидации коагулопатии. ПВ и ПТВ являются хорошими индикаторами функции печени; следует регулярно определять эти показатели. Заместительная терапия факторами свертывания свежезамороженной плазмы требуется лишь при наличии значительного кровотечения. При МПН чаще всего встречаются желудочно-кишечные кровотечения, нередко вследствие стрессового гастрита, поэтому в качестве профилактической меры следует поддерживать внутрижелудочный рН выше 5 путем в/в введения циметидина или ежечасным введением антацидов через назогастральный зонд.
5. Лечение гепатаргии требует устранения усугубляющих факторов (белка, дегидратации, седативных препаратов, гипокалиемии), ограничения или прекращения приема белка (следует вводить ежедневно 1400 калорий в углеводах), введения лактулозы и/или неомицина (перорально или через назогастральный зонд), а также клизм с водой или 20% лактулозой в клизме либо назначения слабительных.
6. Гепаторенальный синдром (ГРС) со снижением экскреции соли и воды нередко встречается при хронической или острой печеночной недостаточности. Усугубляющими факторами является введение нестероидных противовоспалительных препаратов, дегидратация, а также повышение диуреза. Развернутый синдром выражается олигурией, снижением натрия мочи менее 10 ммоль/л, а также азотемией у больного с адекватной гидратацией. Поддерживающее лечение заключается в мониторинге водно-электролитного баланса больного (для того чтобы отличить выраженное снижение ОЦК от ГРС требуется определение давления в правом предсердии, Рппр, либо легочного капиллярного давления заклинивания Ркз), а также в поддержании соответствия поступления натрия и воды их потере. Диализ используется редко, так как почечная недостаточность сама по себе редко бывает основной причиной смерти этих больных.
7. Отек мозга с его заклиниванием нередко осложняет МПН. Некоторым больным требуется мониторинг внутричерепного давления с в/в введением маннита при увеличении давления свыше 30 мм рт. ст.
8. Больные с печеночной недостаточностью весьма чувствительны к бактериальным инфекциям, возможно, частично вследствие дефицита комплемента; поэтому необходим тщательный уход за легкими и кожей, а также безусловная стерильность используемых катетеров. Появление лихорадки или лейкоцитоза должно стимулировать интенсивный поиск очага инфекции и немедленное лечение.
9. Кратковременный прогноз МПН неудовлетворительный; общая смертность достигает 50-80%; тщательный уход и интенсивное поддерживающее лечение повышают выживаемость. Нередко возможен кратковременный успех при лечении осложнений хронической печеночной недостаточности. Долговременный прогноз считается отличным для больных, переживших МПН, так как полная регенерация печени происходит без остаточного ее повреждения; в то же время прогноз неутешителен у больных с хроническим печеночным заболеванием.
Дата добавления: 2014-12-30; просмотров: 1298;
