Развитие структурной химии
Наш мир состоит не из 105 элементов, а из огромного числа их соединений. Формулы и модели, построенные химиками, должны объяснять состав химических соединений и их свойства. Как отмечал историк науки Дж. Партингтон, «стремление иметь свой собственный набор формул явно рассматривалось как проявление независимости мышления каждого химика».
|
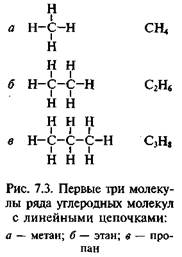
Так, Ф. Кекуле предложил для уксусной кислоты 19 формул — каждая формула объясняла одну реакцию (1861). Но здравый смысл подсказывал, что вещество должно иметь молекулы определенной формы. С позиции геометрии было только определенное количество возможностей построения некоторой модели молекулы, и ни одна из них не объясняла всех свойств веществ. Как только Кекуле предложил простую гексагональную схему для объяснения ароматических соединений, он столкнулся с проблемой локализации химических связей. Понимая, что четырехвалент-ность углерода ведет к тому, что каждый атом углерода имеет одну неза-действованную связь, он принял идею чередующихся одинарных и двойных связей (рис. 7.3, а). Но тогда могут быть получены два изомера (рис. 7.3, б): первый — с двойной связью между добавленными атомами хлора, второй — с одинарной. Но таких изомеров не существует ни с хлором, ни с другими добавленными группами. И в 1872 г. Кекуле предложил идею о том, что связи постоянно «изменяют положение между чередующимися секциями, как пара распахивающихся дверей» (рис. 7.3, в).
Кекуле не придавал большого значения своим формулам, используя их только в качестве символов для объяснения реакций. В то же время А.М.Бутлеров, напротив, считал, что каждому веществу должна отвечать своя формула с реальным, пусть и не определенным отношением к действительной структуре. Он писал: «Для каждого тела возможна будет в этом смысле одна рациональная формула, и когда сделаются известными общие законы зависимости химических свойств тел от их химического строения, то подобная формула будет отражением всех этих свойств».
Энергетическая неравноценность разных химических связей определяла в теории Бутлерова химическую активность веществ. В некотором роде он осуществил синтез представлений атомистики с непрерывностью химических отношений идеей, отвергнутой Ж.Прустом и Дж.Дальтоном. Появилась новая характеристика — непрерывность изменения энергии химических связей.
Теория Бутлерова называется теорией химического строения потому, что в ней химическая связь и химическая энергия — основа объединения атомов в молекулы. Валентность стала структурной характеристикой связанного атома. Так, водород при переходе из одного соединения в другое меняет свои при-
 знаки: в НС1 он предстает как катион, в Н—СН3 и Н—Н — как ковалентно связанный атом, а в Н—Na — как анион. Тогда реакционная способность отдельных фрагментов молекулы определяется энергией связи: для Н—СН3 Е = 412, Н—С (СН3)2 Е = 335, Н—С (С6Н5)з Е=67кДж/моль. Теория Бутлерова установила порядок связей и стала действенным орудием органического синтеза. Были синтезированы многие лекарства, красители, взрывчатые вещества. Но в производстве использовалось дорогое органическое сырье, способы получения многих необходимых веществ не были понятны. Например, при выращивании кристаллов с определенными дефектами в решетке было непонятно, как избавиться от других дефектов.
знаки: в НС1 он предстает как катион, в Н—СН3 и Н—Н — как ковалентно связанный атом, а в Н—Na — как анион. Тогда реакционная способность отдельных фрагментов молекулы определяется энергией связи: для Н—СН3 Е = 412, Н—С (СН3)2 Е = 335, Н—С (С6Н5)з Е=67кДж/моль. Теория Бутлерова установила порядок связей и стала действенным орудием органического синтеза. Были синтезированы многие лекарства, красители, взрывчатые вещества. Но в производстве использовалось дорогое органическое сырье, способы получения многих необходимых веществ не были понятны. Например, при выращивании кристаллов с определенными дефектами в решетке было непонятно, как избавиться от других дефектов.
В понятие структуры вошло понятие энергетическая прочность химических связей. Понятие «свойство вещества» расчленилось на два: химические свойства макроскопического тела и реакционная способность отдельных структурных элементов, всей молекулы и всего вещества как совокупности молекул. Свойства вещества оказались зависящими не только от его состава, но и от структуры молекул. На основе учения о валентности была разработана теория строения молекул. Под молекулярной структурой понимают сочетание определенного числа атомов, закономерно расположенных в пространстве и связанных друг с другом посредством химической связи.
Вскоре были открыты оптические и геометрические изомеры органических соединений, которые можно объяснить только разным пространственным расположением молекул. В 1874 г. Я. Вант-Гофф и Бель выдвинули стройную концепцию, получившую название стереохимии. Они расширили теорию Бутлерова, описав изменения свойств вещества под влиянием таких факторов, как зеркальная изомерия, эффекты вращений вокруг какой-то связи и др. Вант-Гофф в книге «Химия в пространстве» высказал мысль о том, что четырехвалентный атом углерода в органических соединениях, расположенный в центре тетраэдра, в вершинах которого находятся связанные с углеродом атомы или атомные группы, является асимметрическим. Из анализа оптических свойств органических соединений он заключил, что любое соединение, вызывающее в растворе поворот плоскости поляризации, содержит атом углерода.
Изучением структур неорганических соединений занялся швейцарский химик А. Вернер и создал координационную теорию комплексных соединений. В «комплексах» вокруг центрального атома группируются в большом количестве атомы, радикалы и даже молекулы из-за возникновения так называемых вторичных валентностей. На основе его теории в наши дни объясняется химическое строение таких веществ, как гемоглобин, хлорофилл, ферменты, лаки. Он обнаружил предсказанные ранее оптически ак-
тивные неорганические изомеры — соединения железа, кобальта и хрома. Так оптическая активность перестала быть связанной только с атомами углерода.
Сразу же после открытия электрона начали предприниматься попытки связать его с природой химической связи. Немецкий физик Й. Штарк ввел понятие валентных электронов, связав валентность элемента с числом электронов на периферии атома.
Начало квантовой химии было положено работами Ф.Лондона и В.Гайтлрра (1927). Они уже говорили об электронном облаке, и вероятность нахождения электрона в какой-то области определяли как квадрат волновой функции. Первые расчеты молекулы водорода показали, что ковалентную связь образуют два электрона с антипараллельными спинами. При этом увеличивается электронная плотность между двумя атомами почти до 20 %, что приводит к уменьшению энергии системы и ее стабилизации. Поэтому пребывание двух таких электронов энергетически более выгодно, чем нахождение одного электрона в поле своего ядра. Так как у атома водорода только один неспаренный электрон, он функционирует как одновалентный элемент. У гелия в нормальном состоянии нет неспаренных электронов — два электрона находятся на одной орбитали. Поэтому возбуждение атома гелия требует больших затрат энергии — 1672 Дж/моль. Такие энергии в ходе обычных химических реакций не наблюдаются, и гелий ведет себя как инертный газ.
Для расчета достаточно сложных молекул американский физик и химик Л. Полинг в 30-е гг. XX в. усовершенствовал и применил метод атомных орбиталей. Его резонансная теория валентности — это попытка объяснить структуру таких молекул, как бензол. По этой теории связи между атомами углерода в молекуле бензола грубо могут описываться как дробные. Такое описание подтверждается данными электронной дифракции и инфракрасной спектроскопии: если расстояние между атомами углерода с одинарной связью равно 1,54 10-10 м, с двойной — 1,33 10-10 м, то измерение для связей бензола дает 1,40 • 10-10 м, т.е. промежуточное значение между измерениями для одинарной и двойной связи.
Полинг писал: «Мы можем сказать... что молекула не может быть удовлетворительно представлена любой отдельно взятой структурой валентной связи и оставить попытки связать ее структуру и свойства со структурой и свойствами других молекул... Но с помощью понятия резонанса мы можем дать объяснение свойствам молекулы, прямо и просто оперируя свойствами других молекул. Для нас удобно говорить о резонансе молекул среди нескольких электронных структур». Хотя теория резонанса не опирается концептуально на квантовую механику, но она применяется при расчете таких свойств молекул, как стабильность во время реакции. Уравнение Шредингера записывается для каждой из ре-

 зонансных структур, потом волновые функции объединяются линейно, но к каждому уравнению добавляется свой фактор, зависящий от того «влияния», которое каждая идеальная структура осуществляет. Наибольшую известность (и две Нобелевские премии) Полингу принесли расчеты атомной структуры молекул белков. Но трудности вычислений «заморозили» выполнение намеченной обширной программы химических исследований (точные расчеты были сделаны только для водорода, а остальные — на приближениях к водороду), и особого прогресса в развитии химии как науки до широкого использования ЭВМ не произошло.
зонансных структур, потом волновые функции объединяются линейно, но к каждому уравнению добавляется свой фактор, зависящий от того «влияния», которое каждая идеальная структура осуществляет. Наибольшую известность (и две Нобелевские премии) Полингу принесли расчеты атомной структуры молекул белков. Но трудности вычислений «заморозили» выполнение намеченной обширной программы химических исследований (точные расчеты были сделаны только для водорода, а остальные — на приближениях к водороду), и особого прогресса в развитии химии как науки до широкого использования ЭВМ не произошло.
Исследовать молекулярные структуры с помощью рентгеновского излучения начали М.Лауэ, Г. и У.Брэгги, П.Дебая и др. Развивался рентгеноструктурный анализ, использовались дифракция рентгеновских лучей и электронов, спектроскопические методы и метод ядерного магнитного резонанса, что позволило определить строение огромного числа молекул. Это и повлияло на развитие методов молекулярной спектроскопии — для наблюдений стали использовать высокочувствительные спектрографы, а для обработки данных — быстродействующие ЭВМ. Наиболее ценным интеллектуальным достижением химии является точное установление молекулярных структур огромного числа веществ — от чистейшей воды и сложных бронзовых сплавов до белка родопсина в палочках сетчатки глаза человека.
Переход от структурной химии к учению о химических процессах — переход на еще более высокий уровень знаний, когда объекты изучаются более разносторонне. При обсуждении теории Бутлерова выяснилось, что связи не должны быть «жесткими». На усилении динамических факторов в понятии структуры настаивал известный химик Н. А. Меншуткин. Масс-спектроскопические и радиоспектроскопические методы дали информацию о динамических аспектах молекул, но не поколебали основных положений структурной химии. В 60-е гг. XX в. выяснилось, что часть систем, которые ранее интерпретировались как качественно отличные друг от друга изомеры, «можно описать как процессы миграции определенной группы атомов между атомными центрами в качественно неизменной молекуле» (Ю.Жданов, Л.Олехнович и В.Минкин). То, что валентность может быть не целочисленной, обнаружилось в новых соединениях, но введение координационного числа не прояснило ситуацию. Квантовая химия вместо валентности свободного атома ввела понятие спин-валентности — числа электронов с неспаренными спинами на внешних орбитах. Вместо подсчета целого числа связей атома с другими атомами рассчитывается сумма кратностей всех его связей, которая может быть и не целочисленной. Теория резонанса Полинга вызвала в свое время острые философские дискуссии. Можно считать, что она явилась удобной моделью: как и в случае с интерпретацией квантовой теории, модель резонансной структуры оказалась далекой от при-
вычных описаний природы и вызвала некоторое смущение части философов и естествоиспытателей проблемой использования моделей вообще.
Наличие или отсутствие связи между атомами изображают в виде графических или структурных формул. Появился термин «топология молекул». Как известно, топология — это раздел математики, который изучает свойства тел, не зависящие от их формы и размеров, или неметрические свойства. Молекулы же обладают как метрическими (длины химических связей, углы между ними и т.п.), так и неметрическими (могут быть циклическими и нециклическими, как бензол и н-бутан соответственно, и т.п.) свойствами. Топология молекулярных систем связана с их свойствами.
Дата добавления: 2014-12-27; просмотров: 1120;
