Представление о строении молекул
Представление о веществе в естествознании менялось в соответствии с уровнем развития знаний и использования веществ.
В Древней Греции появилась гениальная догадка — тела образованы различными комбинациями атомов (неделимых). Такое объяснение — сведение сложного к простому (редукции) не отражало многообразия сложного мира, но дало науке многое. Тенденция к поиску «элементарных кирпичиков» мироздания, порожденная атомистической концепцией, оказалась плодотворной в объяснении свойств тел. Но она не позволяет понять макроскопические свойства тел, ведь применительно к отдельному атому нельзя говорить ни о давлении, ни о температуре, ни о плотности. И «целое» не является суммой «частей», оно обладает более сложными свойствами. Это приводит к размышлениям о сущности редукционизма и методов познания. Ученые установили, что все вещества построены из молекул, которые, в свою очередь, состоят из устойчивых групп соединенных друг с другом атомов.
Молекула — наименьшая устойчивая частица вещества, сохраняющая его свойства. Понятие молекулы появилось в кинетической теории газов (см. гл. 4), и на основании развитой физической теории удалось путем исследования макроскопического поведения газов оценить размеры молекул. В жидкостях или твердых телах, где молекулы расположены достаточно плотно, их размеры можно оценить по плотности веществ. Прямое доказательство существования молекул было получено при изучении броуновского движения Ж. Перреном.
Установление связи между структурой и свойствами на молекулярном уровне строения веществ — одна из основных задач исследования. Молекула состоит из ядер атомов и электронной оболочки, образованной их внешними электронами. В зависимости от строения и состава молекулы обладают разной степенью устойчивости по отношению к внешним воздействиям, что определяет многие их свойства. Исследование устойчивости молекул раскрывает их природу и реакционную способность. Такими физическими методами, как спектроскопия, ядерный или парамагнитный резонанс и др., изучают разнообразные и сложные химические


 процессы. Относительное расположение атомных ядер в молекулах может быть измерено методами рентгеноструктурного анализа, электронографии или нейтронографии и др. В основном свойства и строение молекул определяются при исследовании макроскопических образцов веществ.
процессы. Относительное расположение атомных ядер в молекулах может быть измерено методами рентгеноструктурного анализа, электронографии или нейтронографии и др. В основном свойства и строение молекул определяются при исследовании макроскопических образцов веществ.
Химия изучает процессы превращения молекул при взаимодействиях и при воздействии на них внешних факторов (теплоты, света, электрического тока, магнитного поля), во время которых образуются новые химические связи. Взаимодействие электронных оболочек атомов порождает химические связи, создающие определенные конфигурации атомов, отличающие один тип молекулы от другого. Если атомные конфигурации подходят друг к другу, возникает структура, несколько большая, чем до этого была совокупность из атомов по отдельности. Получается насыщенная молекула, присоединить к ней еще какой-то атом почти невозможно. Насыщаемость молекул определяет их постоянный состав для данного вещества и связана с валентностью — способностью атома образовывать химические связи. Инертные газы с трудом образуют химические соединения, так как имеют устойчивую электронную оболочку. Внешняя оболочка атома, которая содержит орбитали самых высоких энергий атома, называется валентной.
Понятие валентности, введенное в науку для описания свойства одного изолированного атома, постепенно стало отражать свойства связанного атома, т.е. атома, находящегося в молекуле и изменившего свои свойства под влиянием других атомов. Его впервые использовал (1853) английский химик Э.Франкленд. Тогда валентность элемента выражалась числом атомов водорода, которое может присоединить или которым можно заменить один атом рассматриваемого элемента. Вместе с немецким химиком А. Кольбе он установил трехвалентность азота, фосфора, мышьяка и четырехвалентность углерода. Они отметили, что валентность зависит как от состояния атомов рассматриваемого элемента, так и от химической природы другого реагента: углерод в соединении с кислородом может образовывать и СО, и СO2. Значит, валентность позволяет оценить формулу химического соединения. Так пришли к понятию стехиометрической валентности.
Немецкий химик Кекуле заключил (1857), что одни элементы могут замещать в ряде соединений три атома водорода, а другие — только один или два. Он ввел понятие химического сродства, означающее число атомов водорода, которое может заменить данный элемент. Число единиц сродства и есть валентность. Под валентностью понимали целочисленную величину, отражающую количество единиц сродства свободного атома любого элемента. Считалось, что атом водорода имеет одну единицу сродства, атом кислорода — две и т.д. Поэтому говорили, что атом углерода при образовании диоксида связывает все четыре единицы сродства, а при образовании оксида — только две: O=С=O и =С=O. Шотландский химик А. Купер предложил обозначать химические связи между атомами в соединениях с помощью черточек (1858). Теории Ке-
куле и Купера объясняли строение и сложных радикалов, и органических соединений — молекула представлялась целостным образованием, которое складывается из атомов за счет полного взаимного насыщения единиц сродства. Они практически одновременно обнаружили способность атомов углерода соединяться друг с другом в длинные молекулы-цепочки, это свойство углерода и породило огромное разнообразие его соединений. Простота и наглядность объяснений вели к аддитивному мышлению.
Современные представления о химической связи основаны на современной теории валентности. Термин «связь» оказался очень точен. Случайных связей не бывает — существуют правила их возникновения. При образовании связи атомы приближаются к достижению наиболее устойчивой электронной конфигурации, т. е. имеющей более низкую энергию. Они могут терять (приобретать) электроны или обобществлять их до достижения такой же конфигурации, как у благородного газа этого же периода, т.е. до значения 2 или 8. Существуют и взаимодействия между атомами, когда электронная оболочка не локализована в отдельных связях — сопряженные.
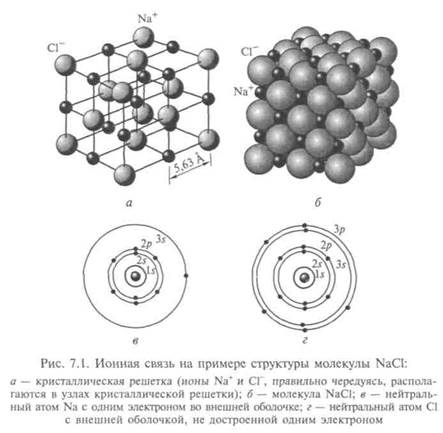
Ионная связь, основанная на переносе валентных электронов от одного атома к другому и электростатическом притяжении этих образовавшихся ионов, — самый распространенный вид связи. Молекула представляется электрическим диполем, а центры ионов в нем расположены на определенном расстоянии друг от друга, называемом длиной связи. Простейшая кристаллическая структура молекулы NaCl показана на рис. 7.1, а схема ее ионной связи NaCl — на рис. 7.2, а. Для хлорида калия, например, длина связи равна 1,3 • 10-10 м.
При ковалентной связи прочное соединение нейтральных атомов достигается за счет более глубокого взаимодействия между ними (рис. 7.2, б), например связь атомов углерода в кристалле алмаза или в молекуле Н2. Прочность такой связи обусловлена обменным резонансом — атомы колеблются с одинаковой собственной частотой, и при связывании их суммарная энергия становится меньше, чем в изолированном состоянии. Электрон 1 притягивается ядром 2, и электрон 2 притягивается ядром 1. Электроны должны иметь противоположно направленные спины, тогда (по принципу Паули) они находятся в наинизшем состоянии и орбиты отдельных атомов сливаются в одну орбиталь, охватывающую пространство обоих атомов водорода и имеющую почти эллиптическую форму. Говорят, что происходит «перекрытие» собственных функций обоих электронов, это становится энергетически выгодно — системы удерживаются вместе.
В молекулах газов сохраняется 5 %-я вероятность того, что электрон несколько смещен к одному из атомов. Молекулы щелочно-галоидных соединений имеют небольшой дипольный момент, их




центры тяжести расположены на некотором расстоянии. В молекуле воды две однократно занятые 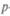 -орбитали атома кислорода частично сливаются с
-орбитали атома кислорода частично сливаются с 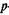 -орбиталью атома водорода, но из-за электростатического отталкивания между обоими ядрами водорода валентный угол не 90, а 105°. Форма молекул с ковалентными связями определяется формой электронных орбиталей. Большинство органических соединений существуют благодаря ковалентной связи.
-орбиталью атома водорода, но из-за электростатического отталкивания между обоими ядрами водорода валентный угол не 90, а 105°. Форма молекул с ковалентными связями определяется формой электронных орбиталей. Большинство органических соединений существуют благодаря ковалентной связи.
Металлическая связь проявляется, когда атомы металла обобществляют валентные электроны, слабо связанные с атомными остовами. Эти электроны образуют электронный газ, перемещающийся по кристаллической решетке (рис. 7.2, в).
Молекулярная связь отражает слабое взаимодействие между соседними атомами, например взаимодействие между атомами водорода в твердом Н2 (рис. 7.2, г). Силы электростатического притяжения могут возникнуть и между нейтральными атомами: при сближении их возникает отталкивание из-за отрицательно заряженных электронных оболочек, но при этом смещается центр
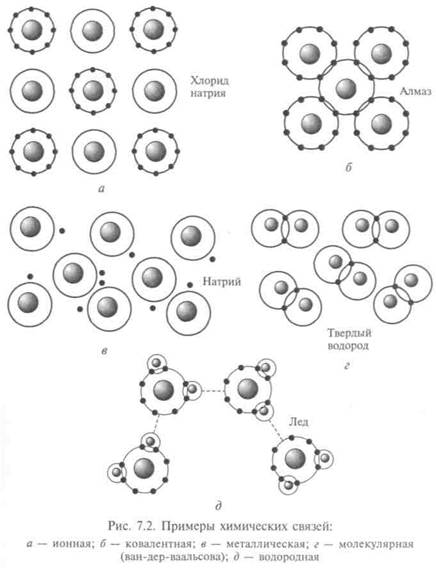
масс отрицательных зарядов относительно положительных. И каждый из атомов индуцирует в другой электрический диполь, что ведет к взаимному притяжению. Это притяжение связывают с действием сил межмолекулярного взаимодействия (сил Ван-дер-Ваальса), которые на порядок меньше по величине, но имеют радиус действия, превосходящий размеры молекул.
Водородная связь слабее ковалентной или ионной связи в 15 — 20 раз. Она возникает, если атом водорода помещен между

 двумя электроотрицательными атомами (рис. 7.2, д). Водородная связь определяет ассоциацию молекул типа димеров воды — (Н20)2. На слабой водородной связи «держатся» полимеры, входящие в состав биомолекул, т. е. и жизнь.
двумя электроотрицательными атомами (рис. 7.2, д). Водородная связь определяет ассоциацию молекул типа димеров воды — (Н20)2. На слабой водородной связи «держатся» полимеры, входящие в состав биомолекул, т. е. и жизнь.
Ионная и ковалентная связи — это предельные случаи химических связей. Чаще всего встречаются молекулы с промежуточными типами связей. Более полное представление о типах связей дают карты электронных плотностей, получаемые из расчетов на ЭВМ. Так квантовая механика атома объяснила проблемы химической связи молекул с позиции физики.
Существуют и очень короткие связи — одинарные, двойные, тройные и даже четверные (в них участвуют сразу 8 электронов), которые обнаруживают между атомами рения, молибдена или хрома. Расстояния между атомами в молекулах очень малы — порядка (1 — 4) • 10-10 м. Так, молекула Н2 состоит из двух связанных между собой атомов, расстояние между ядрами которых, или длина связи, составляет 7,5 • 10-11 м. У молекулы кислорода, также состоящей из двух атомов, длина связи равна 1,2 • 10-10 м. Молекулы различаются и размерами: молекула O2 с 16 электронами больше молекулы Н2 с двумя. Более сложные молекулы имеют и более сложные форму и строение. При образовании молекулы перекрытие электронных облаков ведет к возникновению между ядрами некоторого отрицательного заряда, которое цементирует молекулу и стягивает ядра к области перекрытия. Энергия этого взаимодействия — порядка 1000 кДж/моль (у N2 — 940 кДж/моль, Cs — 42 кДж/моль). Для сравнения: энергия межмолекулярного взаимодействия составляет порядка 100 кДж/моль, так что отличить их по энергии трудно. Важно выделить главную черту химической связи — обобществление валентных электронов и перенос заряда, если связь образуется между разными атомами.
Опыт У.Никольсона и А.Карлейна (1800) по разложению воды с помощью электрического тока впервые показал связь химических и электрических взаимодействий, но только через столетие появилась теория, описывающая природу химической связи. Теория Й. Берцелиуса (1819), основанная на электростатическом взаимодействии зарядов, не могла объяснить образование молекул из двух одинаковых атомов и фактически касалась лишь ионной связи, поскольку электрическая природа других видов химической связи не столь очевидна. Сокрушительный удар по теории Берцелиуса нанесла неведомая ему тогда наука — органическая химия.
Химические связи можно рассматривать с точки зрения превращения энергии: если при создании молекулы ее энергия меньше, чем сумма энергий составляющих ее изолированных атомов, то она может существовать, т. е. ее связь устойчива. Для измерения энергии связи одной молекулы используют энергию, отнесенную к одному молю (числу граммов, равному относительной
молекулярной массе) и деленную на число Авогадро N. Эта величина для O2 равна 487,2 кДж/моль, а для Н2 — 432,6 кДж/моль, т. е. меняется незначительно.
Устойчивым считается состояние, в котором потенциальная энергия минимальна, поэтому при образовании молекулы атомы находятся в потенциальной яме, совершая небольшие тепловые колебания около положения равновесия. Расстояние от вертикальной оси до дна ямы соответствует равновесию — на этом расстоянии находились бы атомы, если бы прекратилось тепловое движение. Точки левее дна соответствуют отталкиванию, правее — притяжению. Крутизна кривой тоже информативна: чем круче кривая, тем больше сила взаимодействия между атомами. Для разных пар атомов различны не только расстояния от вертикальной оси до дна ямы, но и глубина ям. Это просто объяснить: ведь для того чтобы выбраться из ямы, нужна энергия, равная ее глубине. Поэтому глубину ямы можно назвать энергией связи частиц.
Дата добавления: 2014-12-27; просмотров: 2265;
