Структура и уникальные свойства воды
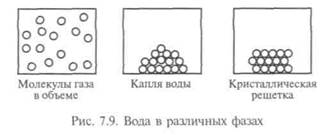
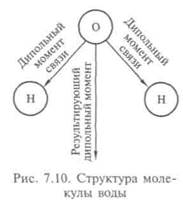
Одно из самых распространенных веществ на Земле — вода. Вода покрывает большую часть поверхности нашей планеты, из нее в основном состоят почти все живые существа. Свойства воды настолько важны для живых организмов, что известная нам форма жизни без нее вообще невозможна (рис. 7.9). Уникальные свойства воды объясняются структурой ее молекул: атом кислорода связан ковалентно с двумя атомами водорода, молекула изогнута под углом, в вершине которого и находится кислород. Из-за того, что кислород притягивает электроны сильнее, чем водород, молекула воды всегда полярна: кислород частично заряжен отрицательно, водород — положительно, поэтому молекула воды удерживается водородными связями. Когда вода находится в жидкой фазе, эти слабые связи легко рвутся и разрушаются при столкно-
|
 вениях молекул, тем не менее водородные связи играют большую роль, обеспечивая особое значение воды для жизни (рис. 7.10).
вениях молекул, тем не менее водородные связи играют большую роль, обеспечивая особое значение воды для жизни (рис. 7.10).
Тепловые свойства воды уникальны для обеспечения жизни. Испарение требует значительной траты энергии, так как температура кипения воды достаточно высока. Скрытая теплота испарения (количество теплоты, необходимой для превращения воды в пар или преодоления сил молекулярного сцепления в воде, обусловленных водородными связями) необычайно велика относительно других веществ. Ее приходится брать из среды, и испарение воды сопровождается охлаждением.
Пример — потоотделение у животных или тепловая одышка у млекопитающих или рептилий (сидят на солнцепеке с разинутым ртом). Относительно большая энергия требуется воде и при плавлении (таянии льда). И наоборот, при замерзании вода должна отдать большое количество тепловой энергии. Это уменьшает вероятность замерзания и клеток, и их окружения. Кристаллизация воды в клетках губительна для жизни, и большая теплота плавления обеспечивает стабильность внешних условий, т.е. жизнедеятельности.
Плотность воды в жидком состоянии больше, чем в твердом, и лед не тонет в ней. Кроме воды таким свойством обладают лишь висмут и чугун. Так как плотность воды при температуре от 4 до 0 °С понижается, лед образуется сначала у поверхности воды и
|
только под конец — около дна. Это обеспечивает сохранение жизни в водоемах: лед покрывает толщу воды, как одеяло, и тает быстрее, находясь на поверхности. Слои воды при температуре, меньшей 4°С, поднимаются вверх, перемешиваются и переносят питательные вещества по всей толще, что позволяет распространяться живому на больших диапазонах глубин. Высокая теплопроводность воды, достаточно высокие температуры кипения и замерзания, понижение температуры тел при испа-
рении воды с их поверхности — все это важно для стабильности условий жизни. Даже тот факт, что плотность воды максимальна при температуре 4 °С, что несколько выше точки ее замерзания (т.е. при охлаждении от 4 до О °С вода расширяется), и лед легче жидкой воды, играет важную роль — предотвращает образование кристаллов в клетках и не повреждает ткани. Низкая плотность льда спасает водных животных — лед плавает на поверхности и не допускает холодный воздух вглубь, где находятся живые организмы. Поэтому вода является вместе с растворенными в ней солями необходимой средой для химических процессов, составляющих жизнь.
Из-за большой теплоемкости воды требуется большое количество энергии даже для небольшого повышения ее температуры. Объясняется это тем, что энергия расходуется на разрыв водородных связей, обеспечивающих ее «клейкость». Поэтому биохимические процессы протекают в меньшем интервале температур, с более постоянной скоростью. Вода служит стабильной средой обитания для многих клеток и организмов, обеспечивая значительное постоянство внешних условий.
Она обладает большим поверхностным натяжением, поскольку ее молекулы слипаются друг с другом (когезия) посредством водородных связей. Полярные молекулы притягиваются любой поверхностью, несущей электрический заряд, отсюда ее способность подниматься по тонкой трубке или порам, называемая капиллярностью (адгезия). Кроме того, у воды самое большое поверхностное натяжение по сравнению с другими жидкостями — сильное сцепление между молекулами. Многие мелкие организмы поэтому могут скользить по водяной поверхности. Это уникальное свойство играет важную роль в живых клетках и при движении воды по сосудам ксилемы у растений.
Вода — активный участник процессов метаболизма. При фотосинтезе она — источник водорода, участвует в реакциях гидролиза. Вода — наиболее важный по объему компонент тканей животных и растений: она является средой, в которой происходят все биохимические реакции, и одновременно их участником. Было установлено, что фазовые переходы в воде могут управлять скоростью протекания биохимических реакций. После открытия По-лингом (1961) взаимосвязи между явлением наркоза и кристаллизацией гидратов наркотических веществ прояснилась роль перестроек связанной воды в явлениях наркоза, а в последнее время — и в возникновении важнейших свойств гидратированных веществ: глины, гипса, цемента, некоторых типов сегнетоэлектриков.
Вода имеет огромное значение при естественном отборе и видообразовании в живой природе. Все наземные организмы приспособились к добыванию и сбереганию воды, даже в пустынях. Не вызывает сомнения тот факт, что жизнь зародилась на Земле в водной среде.

 7.7. Строение и свойства атома углерода, определившие его роль в природе
7.7. Строение и свойства атома углерода, определившие его роль в природе
Примерно из ста химических элементов, встречающихся в земной коре, для жизни необходимы только шестнадцать, причем четыре из них — водород (Н), углерод (С), кислород (О) и азот (N) наиболее распространены в живых организмах и составляют 99 % массы живого. Биологическое значение этих элементов связано с их валентностью (1, 2, 3, 4) и способностью образовывать прочные ковалентные связи, которые оказываются прочнее связей, образуемых другими элементами той же валентности. Следующими по важности являются фосфор (Р), сера (S), ионы натрия, магния, хлора, калия и кальция (Na, Mg, Cl, К, Са). В качестве микроэлементов в живых организмах присутствуют также железо (Fe), кобальт (Со), медь (Си), цинк (Zn), бор (В), алюминий (А1), кремний (Si), ванадий (V), молибден (Мо), иод (I), марганец (Мn).
С точки зрения химии жизнь — это всевозможные превращения разнообразных крупных и сложных молекул, главным элементом которых является углерод. Он важен не с точки зрения распространенности на Земле, в земной коре углерода всего 0,055 %, в то время как кислорода 60,50, кремния 20,45 и даже титана 0,27 %. В атмосфере двуокиси углерода содержится 0,03 %, т. е. углерода всего 0,008 %. Все биологически функциональные вещества (белки, жиры, углеводы, гормоны, витамины), кроме нескольких солей и воды, содержат углерод. Число соединений углерода огромно. Они называются органическими соединениями, поскольку когда-то считалось, что такие молекулы могут образовываться только в живых организмах.
Соединениями углерода занимается органическая химия — одна из важнейших областей химии. Органика разлагается, горит при не очень высокой температуре, при сгорании в воздухе углерод окисляется до СO2. Большинство органических соединений содержат водород, который окисляется до воды. Чистый углерод встречается в природе в виде графита и алмаза. До 1829 г. сторонники витализма считали, что без участия живого нельзя получить органические соединения, только «жизненная сила» способна изготовить уксусную кислоту или спирт. Немецкий химик Ф. Велер доказал ложность этого учения. Он получил мочевину выпариванием раствора цианово-кислого аммония NH4NCO — соли, которую можно изготовить из простых веществ, не связанных с жизнедеятельностью организмов. Этот синтез был первым примером искусственного получения органики.
Сегодня синтезированы сложнейшие вещества, которых нет в природе. Углерод занимает все большее место в технике: природные и синтетические волокна, природный и синтетический кау-
чук, пластмассы, нефтепродукты, бумага, красители, чугун, медикаменты.
Идею о четырехатомности углерода высказал Купер (1858), его поддержал Кекуле в статье «О строении и превращениях химических соединений и химической природе углерода». У Кекуле формула С6Н6 превратилась в структурную формулу бензола, знаменитое «бензольное кольцо», наглядно отражающее четырехва-лентность углерода. Без этого невозможно было понять строение сложных углеводородов, их соединений и производных. Правда, структурные формулы Кекуле были двухмерными и не могли отразить такое свойство молекул, как изомерия. Бутлеров сформулировал определение понятия химического строения как способа связей в молекуле. С помощью структурной теории развивалась систематика органических соединений. Структурные формулы наглядно отражали связь формулы со свойствами вещества, объяснили изомерию и предсказали свойства неизвестных еще соединений.
Атомный номер углерода — 6, ядро содержит 6 протонов и 6 нейтронов, вокруг ядра вращаются 6 электронов, масса атома равна 12. При химических реакциях углерод способен присоединить 4 электрона и образовать устойчивую оболочку из 8 электронов, т. е. имеет валентность, равную четырем, и способен к прочной кова-лентной (присоединением электронов) связи. Например, эмпирическая формула одного из таких прочных соединений, метана, — СН4, а в структурном изображении — это тетраэдр (четыре симметричные связи углерода).
Зная валентность углерода, можно достаточно просто изобразить положение всех недостающих водородных атомов, что позволяет сосредоточить внимание на наиболее важных связях и химических группах. Такие прочные ковалентные связи углерод может образовывать и с атомами других элементов (Н, О, Р, N, S), и с углеродными (С—С-связь). Внутреннее отличие органики от большинства неорганических соединений выражается в том, что химические связи, как правило, в органических соединениях валентные, а ионные связи — очень редки.
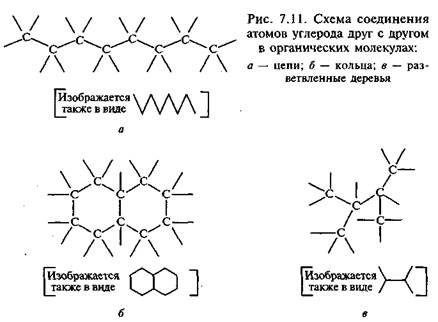
Уникальным свойством углерода является его способность образовывать стабильные цепи и кольца (рис. 7.11), которые обеспечивают разнообразие органических соединений, и эти связи могут быть кратными.
Октан — это восемь атомов углерода в окружении атомов водорода, образующих цепочку, в которой атомы лежат не на прямой, а зигзагообразно, свободно вращаясь в местах сочленения. Октан и его изомеры, состоящие из того же числа атомов, но имеющие разветвленную структуру из-за боковых углеводородных групп, входят в состав бензина. Маленькая капелька этой жидкости имеет больше молекул, чем Галактика звезд. Некоторые молекулы свернуты в клубок, некоторые вытянуты в



длину, большинство же находятся в промежуточном состоянии. Молекула тринитротолуола симметрична. Ее шесть атомов кислорода готовы к окислению: реакция внутримолекулярного высвобождения энергии происходит мгновенно и начинается от легкого толчка.
Разница в строении молекул крахмала (источника энергии) и целлюлозы (строительного материала клеток растений) заключается лишь в небольшом изменении конфигурации водородной связи между мономерными звеньями в цепи. Другой пример: отличие в окраске алых маков от синих васильков связано с отличием одного атома из тридцати, составляющих пигмент окраски. Фиолетовый краситель цианидин, которым особенно богата ежевика, входит в состав обоих цветов. Кислый сок васильков богат ионами водорода, способными в определенном месте присоединяться к молекулам цианидина. Насыщенная водородом молекула активно поглощает красные лучи, отражая синие. У маков щелочная среда практически не содержит свободных катионов водорода, краситель оказывается ненасыщенным, поэтому они поглощают синие лучи, отражая красные. Отличие мужских половых гормонов (тестостеронов) от женских (экстрадиолов) состоит в замене атома кислорода молекулой гидроксильной группы (ОН) и убирании метильной группы (СН3) в одном из нескольких колец, состоящих из десятков атомов молекулы холестерина.
Сравнивая оптические свойства винной и виноградной кислот, Л. Пастер (1848) заметил, что кристаллы двойных солей виноградной кислоты вращают плоскость поляризации на одну и ту же величину, но одни — вправо, а другие — влево. Отсюда он сделал вывод об асимметричном строении кристаллов и о различном
пространственном строении образующих их молекул. После установления строения бензола и создания структурной теории на изомерию обратили особое внимание.
Немецкий химик-органик Й. Вислиценус обнаружил существование двух форм молочной кислоты — оптически активной и неактивной. Он попытался объяснить это явление на основе геометрической изомерии и писал (1875), что это связано, вероятно, с неодинаковым пространственным расположением атомов. Асимметричное расположение атома углерода в это же время отметил и Я. Вант-Гофф, расположив четыре валентности углерода в направлении вершин тетраэдра и поместив атом С в центре. В 1888 г. также немецкий химик-органик В. Мейер назвал такое построение стереохимическим строением и дал тем самым название новой области химии.
В 1890 г. А. Ганч и швейцарский химик-неорганик А Вернер распространили такое изображение на азот, посчитав атом азота находящимся в одной из вершин тетраэдра, а его валентные связи направленными к трем другим вершинам. Впоследствии гипотеза Вернера о координационных соединениях металлов была подтверждена результатами рентгеноструктурного анализа. Явление «обращения» знака оптической активности (можно изменить направление вращения плоскости поляризации заменой одного из атомов (или радикалов) при тетраэдрическом асимметричном атоме углерода) открыл петербургский академик П. Вальден (1896). Так структурная химия перешла от изображения формул на плоскости к их изображению в трехмерном пространстве.
Кратные связи, кроме углерода, могут образовывать фосфор и кислород. Размеры органических молекул определяются углеродным скелетом, а химические свойства — присоединенными к нему элементами и химическими группами, насыщенностью скелета и формой молекул, которая зависит от углов связей. Среди «строительных блоков» — простых органических соединений — крупных молекул можно выделить аминокислоты, из которых синтезированы белки; моносахариды и азотистые основания, синтезирующие нуклеиновые кислоты; жирные кислоты, глицерол и холин, синтезирующие липиды. Таким образом, небольшое число органических молекул дает начало крупным молекулам и структурам живых клеток. Эти немногие виды молекул могли синтезироваться в «первичном бульоне» Мирового океана еще до появления жизни на Земле из простых неорганических молекул — диоксида углерода, азота и воды.
Биохимия, или химия живых организмов, которая сначала развивалась как подспорье медицины, со временем выделилась в отдельную область знания. Она является не только фундаментом физиологии, объясняя работу биосистем, но играет объединяющую роль для всей биологии.
Вопросы для самопроверки и повторения
1. Как развивались представления о составе веществ? Какие основные законы определяют состав веществ? Каково значение закона Авогадро?
2. Дайте определения понятиям «молекула», «химический элемент», «химическое соединение». Как они формировались? Как связываются атомы в молекулы?
3. Приведите отличия теоретического уровня познания от эмпирического (на примерах развития учения о составе веществ). Как точность науки связана с наглядностью моделей?
4. Что изучает химия, каковы основные этапы ее развития? Дайте основные понятия структурной химии.
5. Определите понятие валентности в развитии. Что такое «насыщаемость» связей?
6. Опишите виды химических связей, соединяющих атомы в молекулы и молекулы между собой.
7. Какие формы записи состава веществ существуют и как в них отражаются свойства веществ?
8. С чем связано обилие соединений углерода с точки зрения строения его атома? В каких формах он встречается в природе?
9. Что такое зонная теория? Как она объясняет существование проводников, полупроводников и диэлектриков? Что такое электронный газ?
10. Объясните с позиций структуры воды ее уникальные физические
свойства, важные для живой природы.
Дата добавления: 2014-12-27; просмотров: 3488;
