ЛЕКЦИЯ 5. В термодинамике важную роль играет сумма внутренней энергии системы Uи произведения давления системы р на ее объем V
ЭНТАЛЬПИЯ (теплосодержание)
В термодинамике важную роль играет сумма внутренней энергии системы Uи произведения давления системы р на ее объем V, называемая энтальпией и обозначаемая Н:
H=U+PV
или Δq = dU + Pdυ [34]
Где U – внутренняя энергия 1 кг газа;
PV- работа проталкивания, P и V соответственно давление и удельный объем при температуре, для которой определена внутренняя энергия.
Энтальпия идеального газа численно равна количеству тепла, затрачиваемого при нагревании 1 кг от 0 0С до температуры Т при постоянном давлении. На основе первого закона термодинамики можно записать
qp = u2 - u1 + P(V2 – V1) = (u2 + PV2) – (u1+ PV1)
Или можно выразить по другому.
Уравнение в случае, когда единственным видом работы является работа расширения, с учетом очевидного соотношения Pdυ = d(Ρυ) - υdΡ может быть записано в виде,
δq = d(u + pυ) – υdp или Δq = dh — υdP. [36]
Из этого соотношения следует, что если давление системы сохраняется не-
изменным, т. е. осуществляется изобарный процесс (dP = 0), то
δqp = dh [37]
или qp = h2 – h1 Δh = h2 – h1 = 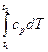 [38]
[38]
т. е. теплота, подведенная к системе при постоянном давлении, идет только на изменение энтальпии данной системы. Следовательно, в процессе протекающем при постоянном давлении, количество подведенного тепла определяется как разность энтальпий в конце и начале процесса.
Для идеального газа с учетом, что 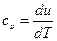 и pV = RT получим
и pV = RT получим
dh = du +d(pv) = cvdT +RdT = (cv +R)dT = cpdT Так как входящие в нее величины являются функциями состояния, то и сама энтальпия является функцией состояния и представляет собой энтальпию системы, содержащей 1 кг вещества, и измеряется в Дж/кг. Так же как внутренняя энергия, работа и теплота, она измеряется в джоулях (Дж). Энтальпия обладает свойством аддитивности.
Изменение энтальпии в любом процессе определяется только начальным и конечным состояниями тела и не зависит от характера процесса.
Дата добавления: 2014-12-24; просмотров: 1694;
