Ионное произведение воды. Водородный показатель. Вода – очень слабый амфотерный электролит: Н20 Н+ + ОН‾ при 24°С=1,6∙10‾9
Вода – очень слабый амфотерный электролит: Н20  Н+ + ОН‾ при 24°С=1,6∙10‾9
Н+ + ОН‾ при 24°С=1,6∙10‾9
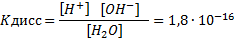
Подставляя в уравнение Кдисс [Н2O]=[Н+]∙[0Н-] концентрацию воды, которая вычисляется из соотношения [Н2O] =1000/18 = 55,5 моль/л, получаем выражение для константы воды: 1,8∙10-16∙55,5=[Н+]∙[0Н-]=1∙10-14=КН2О,
где КН2О=1∙10-14 - ионное произведение воды; КН2О зависит от температуры, с повышением температуры КН2О увеличивается, т.е. диссоциация Н20 происходит с поглощением тепла.
КН2О – постоянна не только для Н2О, но и для разбавленных водных растворов любых веществ [Н+]=[0Н-]=√КН2О=10-7моль/л.
Пользуясь КН2О, можно выразить любую реакцию среды через концентрацию ионов водорода. Нейтральный раствор [Н+]=[0Н-]=10-7моль/л. Кислый раствор [Н+]>10-7моль/л. Щелочной раствор [Н+]<10-7моль/л.
Количественное обозначение реакции среды можно упростить, если ввести водородный показатель pH и гидроксильный показатель pОH, тогда
pH= -lg[Н+]; pОH= -lg[0Н-]. Нейтральная среда pH=7; pОH=7. Кислая средаpH<7; pОH>7. Щелочная среда pH> 7; pОH<7.
Дата добавления: 2014-12-24; просмотров: 982;
