Равновесие в гетерогенных системах, произведение растворимости
Примером гетерогенной системы может служить насыщенный раствор
труднорастворимого соединения, находящегося в равновесии с твердой фазой. К труднорастворимым веществам относятся многие электролиты - соли, основания (чаще всего амфотерные), некоторые кислоты
(H2SiO3; β-H2SnO3 и др.). Так, труднорастворимы галогениды
серебра, сульфаты бария и стронция, карбонаты бария и кальция. Сульфиды металлов, за исключением сульфидов натрия и аммония,
характеризуются очень малой растворимостью. Вследствие малой растворимости раствор труднорастворимого электролита становится насыщенным при очень малых концентрациях растворенного вещества.
Между твердой фазой и раствором электролита устанавливается равновесие, например, AgCl  Ag++CI-
Ag++CI-
твердая насыщенный
фаза раствор
В единицу времени в насыщенный раствор переходит столько ионов, сколько их вновь переходит в осадок. Это состояние равновесия характеризуется величиной константы равновесия
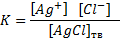
Концентрация твердой фазы – величина постоянная, т.е. [AgCl]тв= const, следовательно, [Ag+][Cl-] также величина постоянная, называемая произведением растворимости (ПР): ПРAgCI=[Ag+]∙[CI-].
Таким образом, в насыщенном растворе труднорастворимого соединения произведение концентраций его ионов при данной температуре
есть величина постоянная. При написании ПР необходимо учитывать
стехиометрические коэффициенты в уравнении диссоциации соединения, например: ПРAg2CrO4=[Ag+]2[CrO42-]; ПРAg3PO4=[Ag+]3[PO43-];: ПРAg2S3=[Ag+]2[S2-]3.
В общем виде для системы КmAn↔mkn+ nAn, ПР выразится следующим образом: ПРKmAn=[Kn+]m[Am-]n.
Из понятия ПР вытекает условие образования и растворения осадков. Если [Kn+]m[Am-]n= ПРKmAn , система находится в равновесии.
Если [Kn+]m [Am-]n>ПРKmAn или [Kn+]m [Am-]n<ПРKmAn, система стремится к новому состоянии равновесия, приводящему в первом случав к выпадению осадка, во втором - к его растворению. Эти процессы будут происходить до
тех пор, пока не будут достигнуты ионные концентрации, соответствующие величине произведения растворимости. В таблице 4 приведены
примеры некоторых труднорастворимых веществ.
Таблица 4
Произведение растворимости некоторых труднорастворимых веществ
| Вещество | ПР | Вещество | ПР |
| CuS | 6,3∙10-36 | α- ZnS | 1,6∙10-24 |
| Cu2S | 25∙10-48 | β - ZnS | 2,5∙10-22 |
| HgS | 3∙10-52 | ZnSe | 1∙10-21 |
Дата добавления: 2014-12-24; просмотров: 1135;
