Патогенез и патоморфология туберкулеза
Патогенез.Туберкулез наиболее часто поражает легкие — основные входные ворота инфекции. Заражение (инфицирование) туберкулезом чаще всего происходит через дыхательные пути (аспирационный путь) при контакте с заразным больным, который при кашле выделяет во внешнюю среду капельки мокроты, содержащие МБТ. Причем только менее 10% этих частиц размером менее 5 мкм попадают в альвеолы и вызывают туберкулезное воспаление. Подавляющее большинство остальных более крупных частиц оседают на слизистой оболочке полости рта и верхних дыхательных путей и удаляются оттуда благодаря функции мукоциллиарного клиренса.
Инфицирование туберкулезом реже возникает при энтеральном попадании МБТ (при употреблении продуктов питания от больных туберкулезом животных).
Для инфицирования и развития заболевания туберкулезом основное значение имеют:
• массивность инфекции, доза и длительность поступления МБТ в организм человека;
• состояние естественной реактивности и факторов защиты организма в период воздействия инфекционного агента.
Механизмы защиты бронхолегочной системы действуют на уровне проводящих и респираторных отделов и осуществляются за счет конденсирования воздуха, механической очистки, фагоцитоза клетками неспецифической защиты и местного иммунитета.
Неповрежденная слизистая полости рта, носоглотки и верхних дыхательных путей — непроницаемый барьер для МБТ. Здесь осуществляется механическая очистка воздуха за счет фильтрации и осаждения инородных частиц, удаления их вследствие чихания и кашля. Наиболее значимая часть механической очистки — мукоцилиарный клиренсна уровне бронхов и бронхиол. Клиренс обеспечивается секретом, содержащим лизоцим, протеазы, сурфактант, иммуноглобулин A (IgA), который обволакивает (опсонизирует) МВТ и движением ресничек реснитчатого эпителия выводит их из организма.
Нарушение целостности слизистой полости рта и носоглотки, кариозные зубы, афтозные стоматиты, парадонтоз, синуситы, хронические тонзиллиты, а также периоды возрастной смены зубов у детей могут являться входными воротами для туберкулезной инфекции.
В трахее и крупных бронхах МВТ, как правило, не задерживаются и оседают в нижних дыхательных путях и альвеолах, где они фагоцитируются нейтрофилами и альвеолярными макрофагами. При этом фагоцитоз — единственный естественный механизм уничтожения МВТ в организме человека.
Локальные изменения в месте внедрения МВТ обусловлены прежде всего неспецифической реакцией нейтрофильных лейкоцитов, которые фагоцитируют, но не разрушают возбудитель (рис. 3.1).
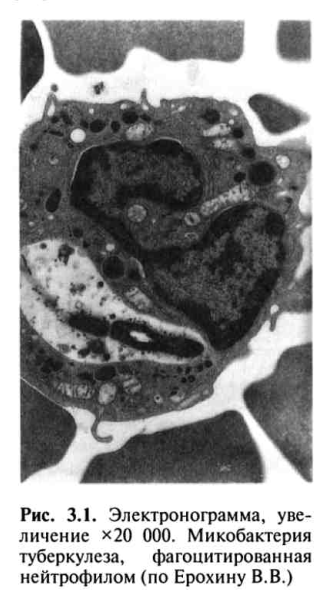
Под влиянием токсинов МВТ нейтрофилы разрушаются, вызывая воспалительную реакцию, которая сменяется более совершенной защитной реакцией с участием альвеолярных макрофагов, также осуществляющих неспецифический фагоцитоз возбудителя (рис. 3.2, см. цветную вклейку). От активности фагоцитоза во многом зависит эффективность всей системы противотуберкулезной защиты организма.
Однако при туберкулезе макрофаги самостоятельно уничтожить МВТ не могут. Необходимо активирующее воздействие на них сенсибилизированных Т-лимфоцитов, в частности субпопуляции Т-хелперов (CD4+ лимфоцитов).
На слизистой альвеол МВТ опсонизируются иммуноглобулином М (IgM), и этот комплекс связывается с Fs-рецептором, расположенным на поверхности макрофага для распознавания чужеродных микроорганизмов. Затем МВТ погружаются (инвагинируют) в цитоплазму клетки с образованием фагосомы, которая сливается с лизосомой с образованием фагосомо-лизосомного комплекса.
Лизосомы представляют весьма сложный комплекс органелл, содержащих большое число протеолитических ферментов, способных разрушать самые различные макромолекулы. Оптимальные условия для функционирования этих ферментных систем обеспечиваются благодаря слабой кислотности среды внутри лизосом (pH около 5).
Однако МВТ, попадая в макрофаги, могут сохраняться в фагосомах и даже продолжать размножение. При этом не происходит слияния фагосомы с лизосомой и неспецифический фагоцитоз носит незавершенный характер.
Механизмы, способствующие незавершенному фагоцитозу, до конца не установлены, но имеются данные, что в процессе размножении МВТ могут продуцировать аммиак и корд-фактор (фактор вирулентности).
Аммиак, с одной стороны, способен ингибировать слияние фаго-сомы с лизосомой, а с другой — путем защелачивания содержимого лизосомы снижать его ферментативную активность. Корд-фактор разрушительно действует на энергетический метаболизм макрофагов, вызывая поражение митохондрий и нарушение синтеза АТФ, что ведет к клеточной дистрофии и гибели клеток и в то же время тормозит синтез лизосомальных ферментов, что предохраняет МВТ от разрушения и повышает внутриклеточную выживаемость возбудителя, защищая его от механизмов лизиса в макрофаге (рис. 3.3).
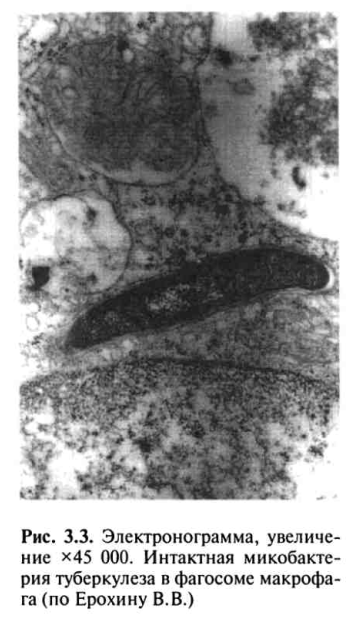
В случаях блокирования процесса переваривания МВТ происходят разрушение макрофагов и выход МВТ из поглотивших их клеток, которые в свою очередь вновь фагоцитируются другими макрофагами. Незавершенный фагоцитоз макрофагами МВТ играет двоякую роль, обеспечивая не только защиту от туберкулеза, но и создавая благоприятные условия для выживания МВТ.
Иммунопатогенез. В процессе фагоцитоза макрофаги синтезируют биологически активные вещества (цитокины) (см. рис. 3.2, см. цветную вклейку):
• фактор некроза опухоли альфа (TNF-α) — вызывает воспаление, тормозит размножение МВТ, усиливает миграцию и активирует новые макрофаги, поступающие из кровеносных сосудов;
• интерлейкин-1 (ИЛ-1) — привлекает и активирует Т-лимфоциты-хелперы (CD4+ лимфоциты), поступающие из кровеносных сосудов.
При этом основная роль в развитии противотуберкулезного иммунитета отводится субпопуляции Т-лимфоцитов-хелперов или CD4+ лимфоцитам.
Координация взаимодействия между макрофагами и CD4+ лимфоцитами рассматривается как центральное звено в формировании противотуберкулезного иммунитета. При этом макрофаги представляют собственно эффекторы, а CD4+ лимфоциты выполняют функцию индукторов ГЗТ.
Развитие первичного и вторичного Т-клеточного иммунного ответа при туберкулезе представлено на рис. 3.4, см. цветную вклейку.
Первичный Т-клеточный иммунный ответ развивается при первичном заражении. При этом поступающие из капилляров периферической крови CD4+ лимфоциты вступают в контакт с макрофагами и получают информацию о фагоцитированных МВТ.
CD4+ лимфоциты (Т-хелперы) активируются и синтезируют цитокины:
• интерлейкин-2 (ИЛ-2) специфически активирует новые макрофаги, поступившие из крови, в отношении МВТ;
• интерферон-гамма (IF-ϒ) усиливает специфический фагоцитоз макрофагами МВТ.
При первичном заражении инфекционный иммунитет развивается через 2-3 нед после первичного инфицирования, а достаточно выраженный иммунитет формируется через 6—8 нед.
Точные механизмы, с помощью которых уничтожаются МБТ, еще полностью не установлены. Тем не менее уже хорошо известны антимикобактериальные функции активированных макрофагов:
• качественное образование фагосомо-лизосомных комплексов;
• генерация реактивных продуктов кислорода (O2) при кислородном взрыве и образование перекиси водорода (Н3O3) в фагосомо-лизосомных комплексах под влиянием IF-ϒ;
• генерация реактивных продуктов азота (N) и образование оксида азота (NO) по L-аргинин-зависимому цитотоксическому пути в фагосомо-лизосомных комплексах под влиянием IF-ϒ и с помощью TNF-α.
Таким образом, фагоцитоз МБТ становится завершенным, а уничтожение МБТ активированными макрофагами возрастает в 100-1000 раз (рис. 3.5).
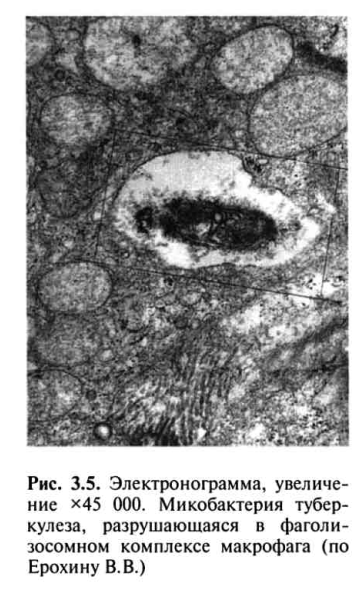
Вторичный Т-клеточный иммунный ответ развивается в иммунном организме при повторном заражении МБТ в течение 24-72 ч. Это связано с циркуляцией в крови специфически активированных CD4+ лимфоцитов памяти, которые тут же мигрируют в ткани органа, куда проникли МБТ, и с помощью цитокинов (ИЛ-2 и IF-ϒ) активируют антимикобактериальные функции макрофагов по уничтожению МБТ.
Морфологический эквивалент формирования защитных иммунных клеточных механизмов организма против туберкулезной инфекции — специфическая гранулема. В гранулеме имеются 3 вида морфологических элементов (рис. 3.6, см. цветную вклейку):
• центр гранулемы представлен казеозным некрозом ткани, который создает неблагоприятные условия для роста МБТ из-за снижения парциального давления кислорода (рО2);
• казеозный некроз окружен макрофагами и лимфоцитами;
• по периферии гранулемы располагаются нейтрофильные лейкоциты.
В некоторых туберкулезных гранулемах по периферии формируются эпителиоидные клетки и гигантские многоядерные клетки Пирогова-Лангханса — несколько слившихся малоактивных макрофагов, являющихся хранилищем МВТ, которые не в состоянии уничтожить своих внутриклеточных паразитов (рис. 3.7, см. цветную вклейку).
По мере формирования противотуберкулезного иммунитета происходит заживление гранулемы, которое начинается с обезвоживания и уплотнения казеозных масс с отложением солей кальция. По периферии гранулемы увеличивается количество фибробластов и фибрилл коллагена, образуется соединительнотканная капсула. В последующем в течение 5-10 лет гранулема полностью замещается соединительной тканью с солями кальция, формируется фиброзный или кальцинированный очаг (рис. 3.8, см. цветную вклейку).
Развитие специфического иммунитета и формирование фиброзных и кальцинированных очагов при первичном туберкулезе не в состоянии полностью уничтожить МВТ. Полное устранение возбудителя при туберкулезе не достигается даже при хорошо скоординированном взаимодействии макрофагов и CD4+ лимфоцитов, в результате чего организм остается инфицирован, хотя активный патологический процесс развивается далеко не во всех случаях. В фиброзных и кальцинированных очагах МВТ трансформируются в L-формы, которые поддерживают иммунитет. Однако любое нарушение иммунного баланса в последующие годы в сторону развития иммунодефицита создает условия для реактивации туберкулеза и развития клинически выраженных форм заболевания.
В развитии туберкулеза можно проследить 3 основных патогенетических варианта течения туберкулеза, когда клеточные реакции организма на внедрение МВТ носят четко разграниченные иммунологические, морфологические и клинические проявления (рис. 3.9).
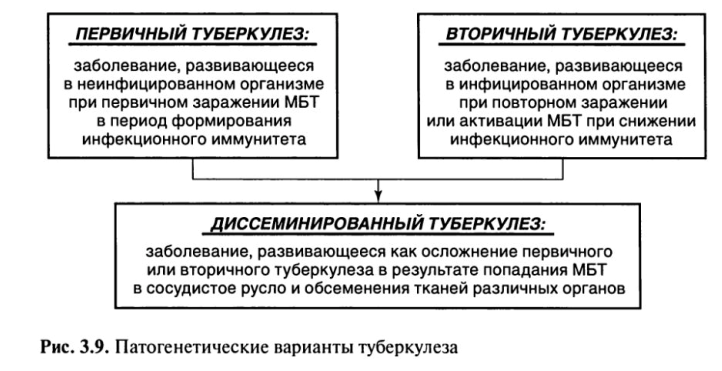
• Вариант течения туберкулеза, связанный с реакцией организма на первичное экзогенное заражение, определяется как первичный туберкулез.
• Вариант течения туберкулеза, связанный с реакцией организма на вторичное заражение (экзогенная суперинфекция) или реактивацию уже заживших постпервичных изменений (эндогенная инфекция), рассматривается как вторичный туберкулез.
• При обоих вариантах течения болезни возможно осложнение, связанное с проникновением МБТ в лимфатические и кровеносные сосуды и обсеменением тканей различных органов, определяемое как диссеминированный туберкулез.
При первичном туберкулезе(рис. 3.10) в зависимости от места входных ворот первичного внедрения МБТ воспалительный очаг (первичный очаг) может образоваться в полости рта, миндалинах, легких, кишечнике — первичный аффект.
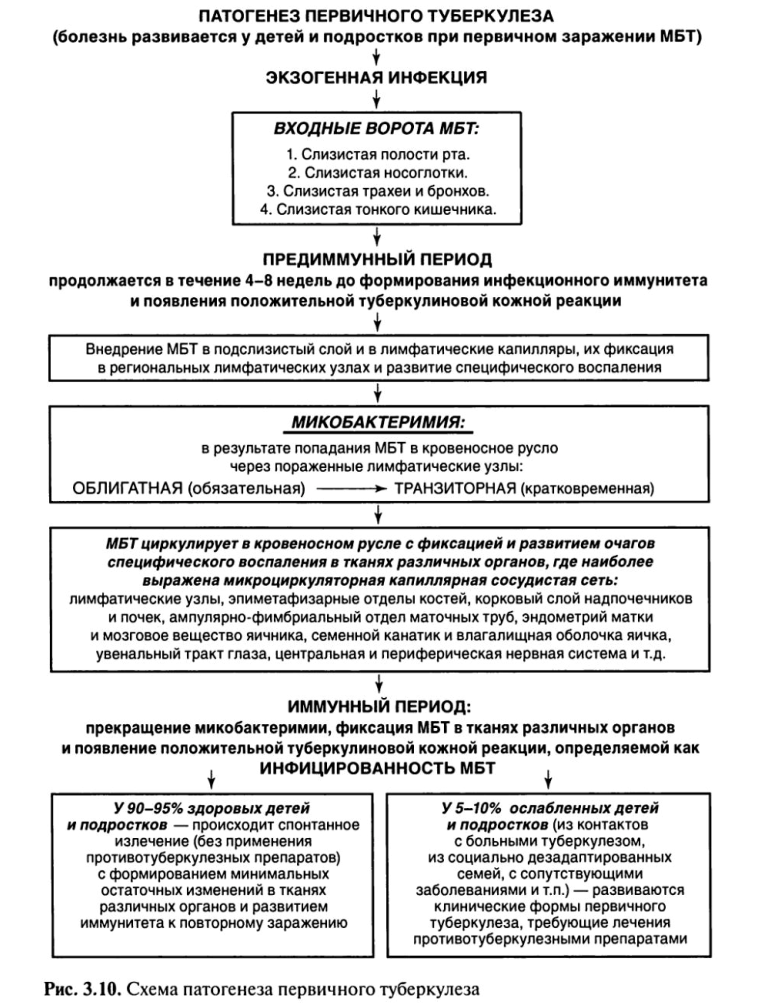
Некоторая часть МБТ остается на месте проникновения, другая с током лимфы и крови переносится к месту внедрения — в региональные лимфатические узлы. В зависимости от локализации входных ворот инфекции могут поражаться подчелюстные, шейные, над- и подключичные, подмышечные, внутригрудные и другие региональные лимфатические узлы.
Последующее размножение МБТ происходит как в легких, так и в лимфатических узлах, и организм реагирует образованием специфической гранулемы.
МБТ, продолжая размножаться, разносятся по организму с током крови и лимфы, возникает так называемая первичная, или облигатная (обязательная), микобактеримия. МБТ оседают и фиксируются в тканях различных органов, где наиболее выражена микроциркуляторная капиллярная сеть (капилляры лимфатических узлов, клубочков коркового слоя почек, эпиметафизарных отделов трубчатых костей, ампулярно-фимбриального отдела маточной трубы, увеального тракта глаз).
Таким образом, с момента первичного заражения туберкулезная инфекция носит генерализованный и системный характер, дающий в последующем возможность развития внелегочных форм туберкулеза.
Первичный туберкулез у 90—95% впервые инфицированных лиц протекает без клинических проявлений, и о наступившем заражении свидетельствует только переход отрицательной туберкулиновой реакции в положительную — вираж туберкулиновых проб. Он может также завершиться спонтанным излечением (без применения противотуберкулезных препаратов) с минимальными (малыми) фиброзными или кальцинированными остаточными специфическими изменениями в легких, внутригрудных лимфатических узлах и тканях других органов.
Только у 5—10% впервые инфицированных лиц развиваются клинические формы туберкулеза с выраженными клиническими проявлениями, что требует лечения противотуберкулезными препаратами. При излечении формируются выраженные остаточные изменения в легких (кальцинированные очаги Гона и Симона), лимфатических узлах (петрификаты или кальцинаты) и тканях других органов.
Отсутствие клинических проявлений первичной туберкулезной инфекции может быть объяснено высоким уровнем естественной резистентности организма человека к туберкулезу, а также приобретенным в результате вакцинации БЦЖ искусственным иммунитетом.
Первичное заражение МБТ, возникающее на фоне послевакцинного иммунитета у вакцинированного вакциной БЦЖ ребенка, происходит по типу вторичного Т-клеточного иммунного ответа и развивается в течение 24—72 ч. Это происходит за счет специфически активированных CD4+ лимфоцитов памяти, которые сразу мигрируют в зону внедрения МБТ и активируют антимикобактериальные функции макрофагов. При этом отсутствуют поражение региональных лимфатических узлов, микобактеримия и развитие очагов в тканях различных органов.
Длительность поствакцинного иммунитета определяется специфически активированными CD4+ лимфоцитами памяти, которые циркулируют в крови в течение 5—6 лет, активируя макрофаги при повторных случаях заражения МБТ. В связи с этим для поддержания поствакцинного иммунитета на достаточно высоком уровне необходимы повторные ревакцинации детей и подростков в возрасте 6—7 и 13-14 лет.
Необходимое условие для развития вторичного туберкулеза — снижение естественной резистентности и специфического иммунитета под влиянием неблагоприятных внешних и внутренних факторов. К таким факторам относят социально-экономическое неблагополучие, социальные стрессы и войны, неблагоприятную экологию, недостаточность питания, сопутствующие заболевания, в том числе алкоголизм, наркоманию, ВИЧ-инфекцию и др. При этом, как правило, у больных вторичным туберкулезом развиваются клинические проявления болезни и практически отсутствует тенденция к спонтанному излечению, что характерно для первичного туберкулеза (рис. 3.11).

Вторичный туберкулез развивается в результате экзогенной суперинфекции (новое заражение) и эндогенной реактивации при обострении остаточных посттуберкулезных изменений различных форм первичного туберкулеза.
Противотуберкулезное лечение может полностью привести к клиническому излечению, однако его отсутствие ведет к летальному исходу. При этом важное значение имеют состояние защитных механизмов макроорганизма, способность противостоять действию возбудителя, развитие полноценных репаративных процессов.
Необходимое условие для развития диссеминированного туберкулеза — выраженный иммунодефицит (рис. 3.12).
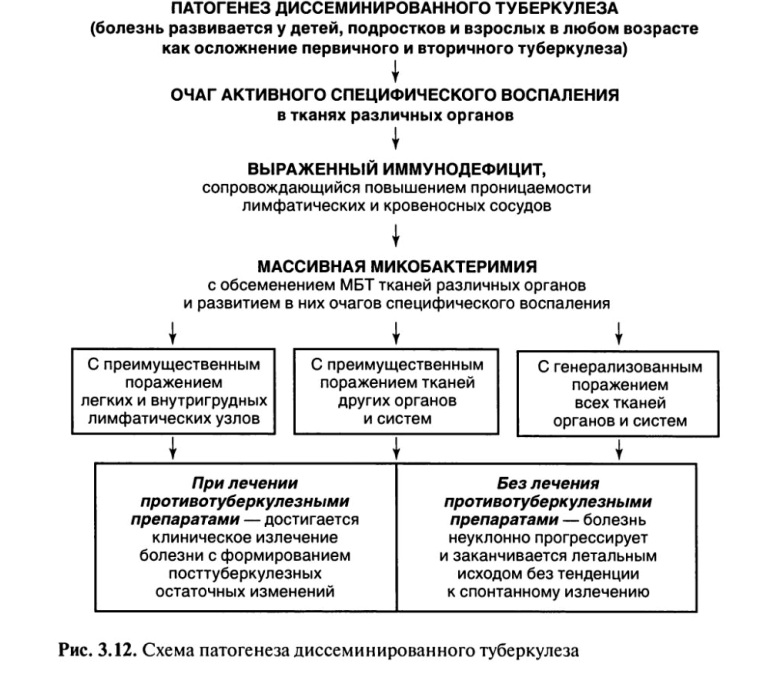
В этих случаях туберкулез развивается при осложненном течении первичного или вторичного туберкулеза, когда из очага специфического воспаления МВТ попадают в кровеносное русло и обсеменяют ткани различных органов с развитием в них очагов туберкулезного воспаления. Течение болезни сопровождается выраженными клиническими проявлениями и высокой вероятностью летального исхода.
Дата добавления: 2019-10-17; просмотров: 3565;
