МНОГОЭЛЕКТРОННЫЕ АТОМЫ
План
1. Принцип Паули. Распределение электронов на энергетических уровнях.
2. Периодическая система Д.И.Менделеева.
1.Принцип Паули. В связи с существованием спина электрона к квантовым числам добавляется квантовое число ms, которое определяет проекцию спина на заданное направление. Число ms, по аналогии с m, нужно было бы называть магнитным спиновым числом. Однако такое название обычно редко применяется. Число ms отличается от спинового квантового числа s только тем, что принимает два значения ±½.Обычно, говоря о спиновом квантовом числе, понимают под ним число ms.
Таким образом, состояние каждого электрона в атоме характеризуется четырьмя квантовыми числами:
главным n = 1, 2, 3,…
орбитальным l = 0, 1, 2, 3,… n-1
магнитным m = -l,…-1, 0, +1,…+l
спиновым ms = +½, -½
На первый взгляд, если атом находится в невозбужденном состоянии, то все электроны атома должны заполнить уровень с наименьшей возможной энергией. Было установлено, что это не так. По мере увеличения порядкового номера атома Z происходит последовательное строго определенное заполнение электронных уровней атома.
Распределение электронов на энергетических уровнях. Порядок заполнения уровней предложил Паули. В 1925 году он установил квантово-механический закон, называемый принципом Паули:
В любом атоме не может быть двух электронов, находящихся в двух одинаковых стационарных состояниях, определяемых набором четырех квантовых чисел: главного n, орбитального l, магнитного m и спинового ms.
Применительно к системе электронов в атоме принцип Паули можно записать следующим образом.
Число электронов, находящихся в состояниях, определяемых набором четырех квантовых чисел n, l, m и ms:
Z1(n,l,m,ms) = 0 или 1.
Число электронов, находящихся в состояниях, определяемых набором трех квантовых чисел n, l и m:
Z2(n,l,m) = 2
Эти электроны отличаются лишь ориентацией спинов, т.е. +½ħ или -½ħ
Число электронов, находящихся в состояниях, определяемых набором двух квантовых чисел n и l:
Z3(n,l) = 2(2l+1)
Так как при заданном числовом значении момента импульса, он может принимать 2l+1 различных ориентаций в пространстве.
Число электронов, находящихся в состояниях, определяемых значением главного квантового числа n:
Z(n) = 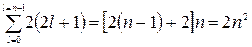 .
.
Совокупность электронов, имеющих одинаковые значения квантового числа n, образует электронный слой.
Слои подразделяются на оболочки,отличающиеся значением квантового числа l.
В соответствии со значением n слоям дают следующие обозначения:
| Значение n | 1 2 3 4 5 6 7 … |
| Обозначение слоя | K L M N O P Q … |
Нарисуем таблицу, в которой определим максимальные числа электронов, находящихся в состояниях, характеризуемых данными значениями главного и орбитального квантовых чисел
| Слой | Число электронов в оболочках | Максимальное число электронов | ||||
| s (l = 0) | p (l = 1) | d (l = 2) | f (l = 3) | g (l = 4) | ||
| K | - | - | - | - | ||
| L | - | - | - | |||
| M | - | - | ||||
| N | - | |||||
| O |
Принцип Паули сыграл выдающуюся роль в развитии современной атомной и ядерной физики. Так, например, удалось теоретически обосновать периодическую систему элементов Менделеева. Без принципа Паули невозможно было бы создать квантовые статистики и современную теорию твердых тел.
2.Периодическая система элементов Менделеева. В 1869 году Менделеев открыл периодический закон изменения химических и физических свойств элементов в зависимости от их атомных масс.
Если расположить химические элементы в порядке возрастания их атомных масс, то периодически, через правильные промежутки, называемые периодами, элементы, оказавшиеся в одном вертикальном ряду (группе) обнаруживают сходные физико-химические свойства.
Однако в ряде случаев приходилось отступать от принципа возрастания атомных масс. Менделеев ввел понятие о порядковом номере элемента, расположив известные в его время 64 химических элемента в таблицу в порядке возрастания их номера. Часть клеток периодической таблицы оставалась свободной, так как не все элементы были известны к тому времени. Таким образом, Менделееву удалось на основании открытого им закона предсказать ряд новых химических элементов (галлий, скандий, германий и т. д.) и описать их химические свойства. В дальнейшем все эти элементы были открыты и предсказания Менделеева полностью подтвердились.
Физический смысл порядкового номера Z элемента в периодической системе элементов был установлен в ядерной модели Резерфорда: Z совпадает с числом положительных заряженных частиц в ядре, закономерно возрастающим на единицу при переходе от элемента к элементу.
Химические свойства элементов и ряд их физических свойств объясняются поведением внешних, валентных электронов атомов этих элементов. Поэтому периодичность свойств химических элементов должна быть связана с определенной периодичностью в расположении электронов в атомах различных элементов.
Важнейшей задачей физики явилось теоретическое истолкование периодического закона Менделеева и объяснение строения периодической системы.
Теория периодической системы основывается на следующих положениях квантовой механики:
Дата добавления: 2019-07-26; просмотров: 540;
