ОБЗОР ИСТОРИИ ГЕРОНТОЛОГИИ 8 страница
Доказательства правомочности такого предположения недавно были представлены T.Kiyono и соавт. [237], которые показали, что введения каталитического компонента теломеразы hTERT или теломеразной активности с помощью онкобелка вируса папилломы человека Е7 в кератиноциты или клетки эпителия человека недостаточно для их полной иммортализации. Она наступает лишь при дополнительном торможении регуляции антионкогена Rb/p16 или при угнетении экспрессии p16 в качестве второй важнейшей ступени этого процесса. Элиминация антионкогена р53 таким свойством не обладала. C другой стороны, протоонкоген c-Myc может активировать экспрессию теломеразы [333], а введение онкогена v-Ha-RAS дрожжам увеличивает продолжительность их жизни [169].
Важные данные получены в Институте молекулярной биологии им.В.А.Энгельгардта РАН [см. 52]. С помощью опосредованного микроклетками переноса маркированную геном neo хромосому 20 из стареющих и молодых диплоидных фибробластов человека ввели в молодые фибробласты. Во всех новообразованных клонах наблюдалось уменьшение пролиферативного потенциала на 17-18 удвоений популяции. Авторы склонны рассматривать полученные данные как свидетельство того, что отдельные теломеры способны ограничить пролиферативный потенциал клеток.
Показано, что старение некоторых тканей, например, эпителиальных клеток слизистой полости рта или роговицы глаза человека in vivo, не сопровождается укорочением теломер [191,235]. Экспрессия белка аденовируса 12 Е1В 54К в нормальных клетках человека сопровождалась существенным увеличением их пролиферативного потенциала (до 100 удвоений). Когда затем деления все же прекратились и клетки перешли в фазу старения, то какого-либо существенного укорочения их теломер выявлено не было [205]. Экспрессию активности теломеразы наблюдали в печени крыс после частичной гепатэктомии [325], то есть в процессе регенерации. Не удалось наблюдать существенных изменений в продолжительности жизни или развитии мышей с "выключенным" (knockout) геном теломеразы [246]. Однако недавно было показано, что выключение гена теломеразы все же приводит к сокращению продолжительности жизни мышей, уменьшению устойчивости к стрессу и увеличению частоты развития новообразований [301]. Авторы отметили, что в остальном физиологические и биохимические параметры животных не свидетельствовали об ускорении у них старения.
Многое в этой области еще предстоит выяснить. Тем не менее, очевидно, что опыты с теломеразой открывают новые перспективы как в геронтологии, так и в онкологии для диагностики рака и, что особенно важно, для его лечения.
2.2.7. Апоптоз и продолжительность жизни
Установление роли соматических мутаций и репарации ДНК в механизмах старения ставит вопрос о их непосредственной связи с процессами дифференцировки и программированной клеточной гибели (апоптоз) и злокачественного роста. Если у одноклеточных организмов лишь репарация повреждений ДНК позволяет им выжить при изменении условий окружающей среды, то у Metazoa оптимальная стратегия в отношении клеток, несущих повреждения ДНК, не столь однозначна, поскольку некоторые мутации в генах, регулирующих клеточную пролиферацию, адгезию и апоптоз, могут приводить к развитию злокачественных новообразований, ведущих к гибели организма. Поэтому, для организма в целом, "безопаснее" иметь механизмы элиминации таких генетически поврежденных клеток, чем риск возникновения очагов неконтролируемого автономного роста. Выбор конкретной "стратегии" организма - репарации ДНК, блокады пролиферации или апоптоза, зависит, во-многом, от типа клеток, их локализации, микроокружения, характера повреждающего фактора и степени повреждения. В любом случае, эффективный ответ на повреждение ДНК является ключевым звеном для выживания многоклеточного организма.
В последние годы достигнут значительный прогресс как в изучении самого феномена программированной клеточной гибели (апоптоза), так и в понимании молекулярных механизмов его реализации и регуляции [99,106,126,194,222,312]. Установлена ключевая роль антионкогена р53 в этом процессе. Опосредованная р53 остановка пролиферации в стадии G1 или G2 клеточного цикла необратима. Такая клетка хотя и не погибает, но генетически она уже "мертва", поскольку не способна к развитию опухоли. Реализации такого эффекта р53 предшествует индукция циклин-зависимого ингибитора киназы р21. Менее ясна роль р53 в стимуляции собственно апоптоза. Установлено, что мишенями для р53 является несколько специфических генов, таких как антагонист гена Bax ген Bcl2, рецептор инсулиноподобного фактора роста-I (IGF-I), связывающий белок IGF-BP3, компоненты ренин-ангиотензин конвертирующей системы и белки, регулирующие ангиогенез [194]. Более того, в некоторых случаях показано участие в этом процессе трансэкспрессии генов анти-апоптоза и даже некоторых нетранскрипционных механизмов. Выявлено также, что р53 участвует в реакции клетки на воздействия, которые не повреждают непосредственно ДНК, например при метоболической депривации, физических травмах, тепловом шоке, гипоксии и экспрессии таких онкогенов как Myc и E1A.
Выше уже обсуждалась модель клеточного старения Хейфлика и роль теломер и теломеразы в продолжительности жизни клеток in vitro. Использование этой модели оказалось весьма плодотворным для изучения механизмов репликативного старения [164,210]. Прекращение способности пролиферировать клеток в культуре можно было объяснить потерей экспрессии пострепликативных генов, например, репрессией с-myc, или неспособностью фосфорилироваться белка ретинобластомы (RB), или, напротив, увеличением экспрессии антирепликативных генов, например, ингибитора циклин-зависимой киназы (cdk) р21. Недавно было установлено, что находящиеся в фазе репликативного старения фибробласты человека резистентны к апоптозу [331]. Угнетение экспрессии ключевых генов G1 фазы, удерживающих стареющие фибробласты человека от вступления в фазу S клеточного цикла, по-видимому, является тем механизмом, который запускает процесс клеточной гибели. Уровень антиапоптотического фактора bcl2 постоянно высок в таких клетках, при этом не наблюдается протеолиза терминина от формы 90 kDa до 30kDa. Таким образом, репрессия генов G1 фазы, увеличение экспрессии гена анти-апоптоза bcl2 и отсутствие протеолиза преставляется, по образном выражению E.Wang [332], крепким "тройным замком", который предотвращает апоптотическую гибель стареющих фибробластов. Весьма существенна в патогенезе апоптоза роль свободных радикалов и ферментов, участвующих в их метаболизме, в частности, цитохрома с [312].
Закономерен вопрос - имеют ли отношение эти результаты, полученные в опытах in vitro, к реальной ситуации старения in vivo, прежде всего, к старению кожи человека? Недавно было установлено, что в коже пожилых лиц стареющие фибробласты содержатся в большом количестве [183]. Хорошо известна высокая чувствительность кожи пожилых канцерогенному действию ультрафиолета и сниженная способность к заживлению ран [139,144]. Cледует заметить, что еще в 1985 г. P.Ebbesen [189] выявил существенное повышение чувствительности старых мышей к действию промотора кожного канцерогенеза 12-О-тетрадеканоилфорбол-13-ацетата по сравнению с кожей молодых животных. При подкожном введении старым животным самых разнообразных канцерогенных агентов (полициклических ароматических углеводородов, нитрозосоединений, пластмассовых пленок или вируса Молони) саркомы на месте введения развивались с большей частотой и значительно раньше, чем у молодых [139,144]. C другой стороны, стимуляция апоптоза в клетках печени ограничением калорийности питания угнетала развитие пренеопластических узелков в печени у старых крыс и мышей [211,268]. Введение мелатонина стимулировало апоптоз в клетках аденокарцином толстой кишки, индуцируемых 1,2-диметилгидразином, что сопровождалось отчетливым торможением развития опухолей [152], тогда как в постмитотических клетках головного мозга этот геропротектор угнетал индуцированную оксидативным стрессом клеточную гибель [253].
Таким образом, накопление в тканях с возрастом резистентных к апоптозу стареющих клеток, возможно, является тем айсбергом, который аккумулирует множественные повреждения, приводящие, в конечном счете, к неоплазии, нейродегенеративным процессам или смерти вследствие инфаркта миокарда [145, 332].
| "Ваша теория и солидна и остроумна. Впрочем, ведь все теории стоят одна другой." |
| Воланд (М.А.Булгаков, "Мастер и Маргарита") |
2.2.8. Свободнорадикальная теория старения
Одной из наиболее плодотвоpно pазвивающихся в последние годы фундаментальных теоpий является свободноpадикальная теоpия стаpения, практически одновременно выдвинутая D.Harman в 1956 г. [219] и Н.М.Эмануэлем в 1958 г. [132,133,192]. Эта теория объясняет не только механизм старения, но и широкий круг связанных с ним патологических процессов (сердечно-сосудистые заболевания, возрастные иммунодепрессия и дисфункция мозга, катаракта, рак и некоторые другие). Согласно этой теоpии, пpодуциpуемые главным образом в митохондриях клеток молекулы супеpоксида (О2-.), Н2О2, гидpоксильного pадикала (НО. ) и, возможно, синглетного кислоpода ( 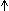 О2) повpеждают клеточные макpомолекулы (ДНК, белки, липиды) [172,219,311]. Полагают, что активные формы кислорода вызывают повpеждения мембpан, коллагена, ДНК, хpоматина, стpуктуpных белков, а также участвуют в эпигенетической pегуляции экспрессии ядерных и митохондриальных генов, приводя к метилированию ДНК, влияют на внутpиклеточный уpовень кальция и т.д. [15,92,106,168,219,245,275,315,342]. Подсчитано, что за 70 лет жизни человека организм производит около одной тонны радикалов кислорода, хотя только 2-5% вдыхаемого с воздухом кислорода превращается в его токсические радикалы. В клетке крысы может возникать до 104 вызыванных активными формами кислорода повреждений ДНК в день и при постоянных условиях до 10% молекул белка могут иметь карбонильные модификации [137]. Подавляющее большинство из них нейтрализуется еще до того, как успеют повредить те или иные компоненты клетки. Так, из каждого миллиона образующихся супероксидных радикалов от ферментной защиты ускользает не более четырех. К основным эндогенным факторам антиоксидантной защиты организма относятся некоторые ферменты и витамины (таблица 3).
О2) повpеждают клеточные макpомолекулы (ДНК, белки, липиды) [172,219,311]. Полагают, что активные формы кислорода вызывают повpеждения мембpан, коллагена, ДНК, хpоматина, стpуктуpных белков, а также участвуют в эпигенетической pегуляции экспрессии ядерных и митохондриальных генов, приводя к метилированию ДНК, влияют на внутpиклеточный уpовень кальция и т.д. [15,92,106,168,219,245,275,315,342]. Подсчитано, что за 70 лет жизни человека организм производит около одной тонны радикалов кислорода, хотя только 2-5% вдыхаемого с воздухом кислорода превращается в его токсические радикалы. В клетке крысы может возникать до 104 вызыванных активными формами кислорода повреждений ДНК в день и при постоянных условиях до 10% молекул белка могут иметь карбонильные модификации [137]. Подавляющее большинство из них нейтрализуется еще до того, как успеют повредить те или иные компоненты клетки. Так, из каждого миллиона образующихся супероксидных радикалов от ферментной защиты ускользает не более четырех. К основным эндогенным факторам антиоксидантной защиты организма относятся некоторые ферменты и витамины (таблица 3).
Показано, что видовая продолжительность жизни прямо коррелирует с активностью супероксиддисмутазы (СОД), содержанием 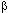 -каротина,
-каротина, 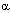 -токоферола и мочевой кислоты в сыворотке крови [171]. Более того, у долгоживущих линий D. melanogaster экспрессия СОД, каталазы, глютатионредуктазы и ксантиндегидрогеназы была достоверно большей, чем у короткоживующих линий мух [154]).
-токоферола и мочевой кислоты в сыворотке крови [171]. Более того, у долгоживущих линий D. melanogaster экспрессия СОД, каталазы, глютатионредуктазы и ксантиндегидрогеназы была достоверно большей, чем у короткоживующих линий мух [154]).
Таблица 3. Факторы, защищающие макромолекулы клеток от повреждения свободными радикалами
| Мишень | Агент | Функция |
| О2 | Супероксиддисмутаза | Превращает О2 в Н2О2 |
| Н2О2 | Глютатион-пероксидаза | Превращает Н2О2 в Н2О и О2 |
| Каталаза | Превращает Н2О2 в Н2О и О2 | |
| Свободные радикалы | 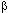 -каротин (провитамин А) -каротин (провитамин А)
| Связывает жирорастворимые свободные радикалы |
Витамин Е ( 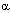 -токоферол) -токоферол)
| " | |
| Витамин С (аскорбиновая кислота) | Связывает водорастворимые свободные радикалы | |
| Мочевая кислота | " | |
| Мелатонин | Связывает жиро- и водорастворимые свободные радикалы | |
| Переходные металлы | Хелатные агенты | Предотвращают катализ свободнорадикальных реакций переходными металлами, железом и медью |
В пользу свободнорадикальной теории старения говорят эксперименты в которых трансгенные линии D. melanogaster с дополнительными копиями генов, обеспечивающих избыточную активностьСОД и каталазы, жили на 20-37% дольше контрольных мух, тогда как мухи с избыточными копиями генов лишь одного из этих ферментов антиокислительной защиты таким эффектом не обладали [274]. Недавно было установлено, что трансгенные дрозофилы с избыточной экспрессией гена SOD1 в мотонейронах жили на 40% дольше и были значительно устойчивее к окислительному стрессу, чем мухи, не имевшие этого гена [277]. Витамин Е, мелатонин, хелатные агенты и некоторые синтетические антиоксиданты увеличивали продолжительность жизни не только дрозофил, но и лабораторных мышей и крыс [38,88,219,291,292]. Однако, то обстоятельство, что продукты взаимодействия АФК с макромолекулами постоянно обнаруживаются в органах и тканях организма, свидетельствует о том, что системы антиоксидантной защиты недостаточно эффективны и что клетки постоянно подвергаются окислительному стрессу. Противодействие ему может играть существенную роль в механизме геропротекторного действия эндогенных и экзогенных антиоксидантов.
| "По черточкам морщин в стекле правдивом Мы все ведем своим утратам счет. А в шорохе часов неторопливом Украдкой время к вечности течет." |
| Вильям Шекспир, 77-й сонет. |
2.3. ФИЗИОЛОГИЧЕСКИЕ МЕХАНИЗМЫ СТАРЕНИЯ
| "Диета, которая обильна, опасна, и также опасно избыточное насыщение. Те, кто от природы жирны - ближе к смерти, чем те, которые тощи". |
| Гиппократ (460-377 гг. до н.э.). |
2.3.1. Ограничение калорийности питания и старение
В 1914 г. профессор Харьковского университета (а до этого -С.-Петербургского ун-та) Е.А.Шульц, изучая регенерацию гидр и планарий (в том числе вызванную голоданием), пришел к выводу, что в ходе этого процесса клетки животных дедифференцируются и переходят в эмбриональное состояние, т.е. молодеют. Скорость же старения ткани по его мнению зависит от того, как часто она подвергается физиологическому обновлению, периодически голодающие животные достигают большей продолжительности жизни, чем неголодающие. Взгляды Шульца были достаточно известны в первой четверти XX в., однако тогда исследование голодания как фактора продления жизни не получило достаточного развития [109].
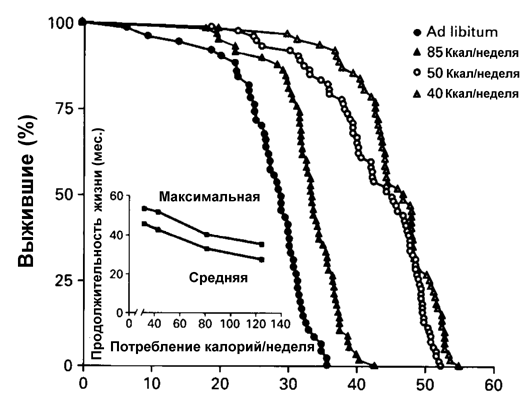
В 1917 г. Osborn описал замедление возрастного выключения репродуктивной функции у крыс, содержавшихся в условиях ограниченного питания. В 30-е годы работами McCay было установлено [257], что диета с ограничением калорий увеличивает на 30-50% максимальную и среднюю продолжительность жизни крыс и мышей. До 60-70 гг. этот феномен, хотя и был воспроизведен во многих лабораториях, в том числе и в СССР [86,122], рассматривался как научный курьез. Однако в последующем эта модель, благодаря своей простоте и устойчивой воспроизводимости стала одной из ведущих в изучении фундаментальных механизмов старения и увеличении продолжительности жизни, хотя при этом наблюдалось замедление не всех возрастных биохимических, физиологических и поведенческих параметров [337,344]. Ограничение калорийности питания увеличивало продолжительность жизни также у рыб, амфибий, дафний, насекомых и других беспозвоночных. Хотя до сих пор нет ответа на вопрос - замедляет или нет ограниченная диета возрастные процессы у человека и влияет ли на продолжительность его жизни, в трех больших исследованиях на приматах (главным образом, на макаках резус) получены первые свидетельства тому, что по крайней мере некоторые физиологические эффекты ограниченной по калорийности диеты, наблюдаемые у грызунов, воспроизводятся и у обезьян [167,174,236,244,300]. Среди этих эффектов - уменьшение уровня глюкозы и инсулина в крови, снижение температуры тела, снижение энергозатрат.
Было установлено, что именно общее снижение потребления калорий, а не какого-либо ингредиента пищи определяет геропротекторный эффект голодания [337] (рис.3).

|
 + +
|
| Рис. 3 |

|
Подсчитано, что 80-90 % из примерно 300 изученных у грызунов, содержащихся на ограниченном по калорийности рационе, разнообразнейших параметров, включая поведение и обучаемость, иммунный ответ, экспрессию генов, активность ферментов и действие гормонов, толерантность к глюкозе, эффективность репарации ДНК, скорость синтеза белка, проявляли черты замедленного старения [315,337,344]. Важно подчеркнуть, что такая диета стимулирует апоптоз, который элиминирует пренеопластические клетки в тканях организма [211,268], замедляет накопление в них мутаций [175] замедляет развитие и возрастной патологии, включая возникновение новообразований [337].
Предполагается, что в механизмах увеличения продолжительности жизни при ограничении калорийности питания основную роль играют такие факторы, как замедление роста, уменьшение содержания жира в теле, замедление нейроэндокринных или иммунологических возрастных сдвигов, увеличение репарации ДНК, изменения скорости биосинтеза белков и экспресии генов, снижение температуры тела и основного обмена, ослабление окислительного стресса. Некоторые из этих механизмов, по-видимому, имеют меньшее, если какое-либо, значение. Так, поскольку ограничение калорийности диеты, начатое в возрасте 12 мес., также увеличивает максимальную продолжительность жизни [337], очевидно, что замедление скорости роста несущественно для продление жизни. Весьма относительно и значение роли снижения содержания жира в теле, поскольку его связь с максимальной продолжительностью жизни у грызунов, содержащихся при питании без ограничения неочевидна, а при ограниченном питании - прямо пропорциональна [337]. Довольно противоречивы данные в отношении роли уменьшения скорости метаболических процессов при ограниченной калорийности питания.
Пожалуй, наиболее значимым эффектом ограниченного по калорийности питания является уменьшение интенсивности свободнорадикальных процессов. У грызунов, содержащихся на такой диете, наблюдается замедление возрастного усиления скорости генерации супероксида и Н2О2, уменьшение окислительных повреждений и замедление возрастного снижения вязкости мембран. Активность ферментов антиокислительной защиты в различных тканях изменяется не столь единообразно, однако голодание снижает чувствительность тканей in vitro к острому оксидативному стрессу [315]. Наибольший защитный в отношении окислительного стресса эффект ограниченного по калорийности питания проявляется в постмитотических клетках головного мозга, сердца и скелетных мышц. При ограничении калорийности рациона не наблюдается возрастного снижения функции эпифиза [319], гормоны которого играют важную роль в антиокислительной защитной системе организма и обладают отчетливым геропротекторным эффектом [9,125,291,292].
Следует отметить, что с помощью некоторых фармакологических средств, в частности, антидиабетических бигуанидов (фенформин, буформин), которые повышают чувствительность тканей к инсулину, улучшают толерантность к углеводам, снижают уровень липидов и устраняют явления метаболической иммунодепрессии, также удается увеличить продолжительность жизни мышей и крыс и снизить у них частоту развития спонтанных новообразований [139,181].
2.3.2. Иммунологическая теория старения
Известно, что с возрастом учащаются случаи различных инфекционных заболеваний, аутоиммунных процессов и опухолей. Возможно, это частично обусловлено возрастными дефектами иммунной системы. Связь столь широкого круга связанных с возрастом патологических процессов с дефектами иммунной системы привела к появлению предположения, что старение иммунной системы может ограничивать продолжительность жизни [329]. Однако, несмотря на то, что выполнено множество экспериментальных и клинических исследований, cвидетельствующих о возрастном истощении иммунной системы, имеющихся данных все же недостаточно для объяснения всех проявлений старения [147,249,251,263,294]. Множество клеточных и гуморальных компонентов, вовлекаемых в иммунные реакции, и большое число модулирующих неиммунных факторов, которые также могут изменяться в старости [215] не позволяют и сегодня нарисовать исчерпывающую картину иммуностарения.
Иммунная и гемопоэтическая система тесно связаны, поскольку имеют единое происхождение от
общих поливалентных стволовых клеток. Обе играют ключевую роль в защите организма, предупреждении развития опухолей и возникновении ответа на инфекционные агенты [249]. Однако оказывается, что с возрастом основной гемопоэз у животных и у человека или не изменяется, или изменяется минимально [249]. Резервные возможности могут сужаться, что приводит к снижению способности реагировать на стрессорное воздействие. Периферические лимфоидные органы, такие как селезенка и лимфоузлы, с возрастом не претерпевают закономерных изменений в размерах. Возраст не вызывает каких-либо поражений костного мозга. Продукция стволовых клеток, как правило, хорошо сохранена в старом возрасте, хотя и имеются данные о слабых изменениях скорости их репликации [218]. Считается, что инволюция тимуса, начинающаяся при половом созревании, является главным возрастным изменением иммунной системы. Такая инволюция состоит в прогрессивной потере клеточности с истощением лимфоидного пула клеток в зонах коры и кистозными изменениями эпителиальных клеток. Они являются источником различных пептидов, вовлекаемых в дифференцирующиеся лимфоидные клетки (Т-клетки) из более молодых лимфоидных клеток. Выход дифференцированных Т-клеток снижается с увеличением возраста [209]. Прогрессивно снижаются синтез и секреция полипептидных гормонов тимуса, таких как тимозин, тимопоэтин и тимулин. Считается установленным, что снижение эндокринной активности тимуса играет ключевую роль в возрастных дисфункциях иммунной системы, поскольку заместительная терапия введением гормонов способна восстановить различные иммунные функции в старости [347]. Обмен цинка, который играет существенную роль в иммунокомпетенции, в старости снижается, тогда как добавки цинка могут восстановить иммунные функции [197].
Зрелые Т-клетки, лимфоциты (В-клетки) костного мозга и естественные клетки-киллеры (NK-клетки) могут быть определены в крови и лимфоидных органах с помощью специфических моноклональных антител. У человека с помощью этого метода не выявлено существенных изменений соотношения различных субпопуляций лимфоцитов. Однако обнаружены серьезные изменения функционирования Т-лимфоцитов [323]. В то время как общее количество Т-клеток в периферической крови в старости заметно не изменяется, наблюдаются четкие различия в относительном количестве подтипов Т-клеток [249,294,323]. Количество незрелых лимфоцитов Т-предшественников увеличивается с возрастом, так же как и процент частично активированных Т-лимфоцитов, несущих маркеры незрелого фенотипа тимуса. Имеет место относительное увеличение цитотоксических супрессорных Т-клеток и уменьшение количества хелперов/индукторов Т-клеток [249,323]. Функциональные дефекты клеточно-опосредованного иммунитета коррелируют с уменьшением популяции хелперов/индукторов [249]. Клетки, полученные от старых людей или лабораторных животных, менее способны к ответу на аллогенные лимфоциты, фитогемагглютинин, конканавалин А и растворимый антиген. Лимфоциты от более старых мышей обладают меньшей способностью вызывать реакции отторжения, чем те, которые получены от более молодых особей тех же инбредных линий [323]. Половина здоровых людей в возрасте старше 50 лет страдает кожной гиперчувствительностью [48,249]. Уменьшение количества хелперов/ индукторов Т-клеток и функций клеточно-опосредованного иммунитета сопровождается ростом количества антител и аутоиммунных реакций [323].
Труднее выявить возрастные изменения гуморального иммунитета (функция В-клеток) [249]. Исследования влияния возраста на продукцию антител дают противоречивые результаты, возможно, из-за широкой вариабельности этих показателей, характерной для стареющих индивидуумов. Однако твердо установлено, что старение значимо ассоциируется с присутствием различных антител, особенно антител против ядерных антигенов. Получены также доказательства, что старение влияет на скорость продукции антител активированными В-клетками [249].
Что касается функциональных изменений, то их нарушения отмечены на различных уровнях. Во-первых, способность к пролиферации Т-клеток старых индивидуумов, как правило, снижена, вне зависимости от стимуляции (антигенами, митогенами), и дефект касается как снижения числа клеток, отвечающих на стимуляцию, так и преждевременного истощения мощности клона отвечающих клеток [196]. Во-вторых, подавляется ответ на многие интерлейкины, которые физиологически опосредуют модуляцию пролиферативной реакции. Этот феномен был зарегистрирован не только в отношении Т-клеток, но также и для NK-клеток, которые менее чувствительны в старом возрасте к действию интерлейкина-2 или интерферона [287]. В отношении вспомогательных клеток (фагоцитов, макрофагов) известно, что их количество и функция не изменяются с возрастом, а при определенных обстоятельствах оказывается, что их активность усиливается.
Важным достижением в изучении механизмов иммуностарения стало установление роли в его развитии возрастных изменений в нервной и эндокринной системах. Связь между нервной и иммунной системами
опосредуется гормонами и нейромедиаторами, которые достигают лимфоидных органов и клеток через кровь или прямые связи с вегетативной нервной системой [215]. Нейроэндокринно-иммунные взаимодействия осуществляются циркуляцией гуморальных факторов эпифизарно-гипоталамо-гипофизарной системы либо непосредственно нейропептидами и гормонами, либо опосредованно через действие компонентов этой системы на секрецию гормонов периферических эндокринных желез, которые также обладают иммуномодулирующей активностью [215]. В экспериментах было продемонстрировано, что воздействие на старых животных гормонами щитовидной железы, гормоном роста и аналогами гормона, высвобождающего ЛГ, способно индуцировать реактивацию эндокринной функции тимуса восстанавливать различные связанные с возрастом периферические иммунодефициты, такие как функциональная полноценность Т-клеток, цитотоксичность NK-клеток [195].
По-видимому, нейроэндокринная система действует не только как модулятор иммунной системы, но также как мишень для сигналов, генерируемых в иммунной системе. Примерами подобных
взаимодействий являются изменения нейроэндокринного баланса, которые могут быть индуцированы или удалением соответствующих лимфоидных органов (например, тимуса), или нарушением функции
иммунной системы в результате реагирования на иммуногенные или толерогенные дозы антигена. Кроме того, зрелые лимфоидные клетки, стимулируемые антигеном, продуцируют гуморальные факторы, сходные (если не идентичные) с классическими гормонами и нейромедиаторами (такими как AКТГ, ТТГ, гормон роста, пролактин, гамма-адреналины) [158]. Эти реципрокные связи между нейроэндокринной и иммунной системами имеют место в течение всей жизни, но приобретают особое значение в период старения [196].
В последние годы было установлено, что некоторые иммуномодуляторы, в частности, пептидные препараты тимуса могут восстанавливать компетентность иммунных клеток в старом организме и увеличивать продолжительность жизни животных [70,81,82,148,150].
| "Природа - сфинкс. И тем она верней Своим искусом губит человека, Что, может статься, никакой от века Загадки нет и не было у ней." |
| Федор Тютчев |
Страница 60 
2.3.3. Элевационная теория старения
К одной из самых ярких и глубоко разработанных концепций в геронтологии по праву следует отнести элевационную теорию старения и формирования возрастной патологии у высших организмов, придающей ключевое значение в этих процессах возрастному повышению порога чувствительности гипоталамуса к гомеостатическим сигналам [44-48,176-179]. На основании изучения возрастной динамики у женщин таких показателей, как состояние репродуктивной функции, наличие приливов, избыток веса тела и уровень холестерина В.М.Дильман еще в начале 50-х годов выдвинул и обосновал идею о существовании единого регуляторного механизма, определяющего закономерности возникновения и развития в организме в процессе его онтогенеза различных гомеостатических систем. Таким механизмом, по его определению, является возрастное повышение порога чувствительности гипоталамуса к регуляторным гомеостатическим сигналам. На протяжении 60-80-х годов в серии экспериментальных исследований и клинических наблюдений было установлено, что именно этот процесс приводит к возрастному включению и выключению функции репродуктивной системы в женском организме, к возрастным изменениям в гипоталамо-гипофизарно-надпочечниковой системе, обеспечивающей тонический уровень глюкокортикоидных гормонов в крови, их циркадный ритм и повышение секреции при стрессе, и, как следствие, развитию состояния, обозначенному как "гиперадаптоз". Следствием аналогичных возрастных изменений в системе метаболического гомеостата, регулирующего аппетит и энергетическое обеспечение функций организма, является нарастание с возрастом содержания жира в теле, снижение чувствительности тканей к инсулину (пре-диабет) и развитие атеросклероза.
Дата добавления: 2019-07-26; просмотров: 296;
