ОБЗОР ИСТОРИИ ГЕРОНТОЛОГИИ 7 страница
Проанализировав данные о гетерозиготности генома у 77 зоологических и 30 ботанических видов, Ю.П.Алтухов [2] выявил, что она высокодостоверно положительно коррелирует со скоростью полового созревания и отрицательно - с продолжительностью жизни. Чем больше индицидуальная гетерозиготность, тем большие энергетические затраты организма приходятся на этот период онтогенеза, выше темпы развития, раньше наступает половозрелость и возраст первой репродукции, и, соответственно, короче оказывается жизнь. Подчеркивается, что долгожительство человека, как и у других биологических видов, определяется высокой индивидуальной гомозиготностью.
Другим аспектом проблемы является оценка важности для продолжительности жизни потомства генетического груза (мутаций), полученных в процессе старения родителями. Частота мутаций в половых клетках мужчин много выше, чем у женщин и пропорционален возрасту и в случае отцовства в позднем возрасте потомство подвергается большему риску генетических нарушений и, соответственно, риску иметь меньшую продолжительность жизни [170]. Особенно это касается дочерей старых отцов, у которых продолжительность жизни явно короче. В наших опытах на крысах не наблюдалось различий в продолжительности жизни потомства, произведенного молодыми (3-мес.) самками и самцами и молодыми самками и старыми (27 мес.) самцами, однако потомство старых самцов было значительно более чувствительно к канцерогенному действию N-нитрозометилмочевины [146] что свидетельствует в пользу точки зрения о накоплении с возрастом генетических повреждений в мужских половых клетках.
Следует отметить, что анализ современных данных о смертности в различном возрасте у человека, насекомых, червей и дрожжей привел к неожиданному выводу, что в самых старших возрастных группах показатели смертности уменьшаются [327]. Полученные доказательства продления пострепродуктивного периода жизни у различных видов животных ставят перед исследователями много недоуменных вопросов и требуют пересмотра многих сложившихся представлений на природу старения и роль генетических и негенетических факторов в определении продолжительности жизни.
Страница 58 
2.1.4. Гены гибели и долголетия у беспозвоночных
В последние годы существенный прогресс в исследовании генетики старения связан с работами на беспозвоночных (нематодах и плодовых мушках). Нематода Caenorhabditis еlegans (С.еlegans), маленький земляной червь, является идеальной моделью для идентификации генов смерти и долголетия. Продолжительность жизни этого червя составляет около 20 дней, что весьма удобно для изучения эффектов генов и генетических манипуляций. Черви размножаются гермафродитическим самооплодотворением, что ведет к созданию популяций однотипных червей. Существование популяций С.еlegans с разной длительностью жизни убедительно демонстрирует, что темп старения находится под генетическим контролем. C помощью химических мутагенов удалось получить червей с большей на 50% средней и в 2 раза максимальной продолжительностью жизни, чем у их предшественников. Был идентифицирован ген age-1, модификация или супрессия продукта которого приводила к увеличению продолжительности жизни. Age-1 определяет активацию спермы, он рецессивен и плотно сцеплен с геном fer-15, влияющим на репродукцию. Разделить эти два гена с помощью кроссинговера не удалось, поэтому предположили, что age-1 и fer-15 являются одним и тем же геном, при этом, одной из функций продукта дикого типа гена age-1 может быть усиление репродуктивных свойств, а другой - снижение продолжительности жизни, и следовательно age-1 может быть одним из регуляторов процесса старения, по крайней мере для этого вида [228,231,232].
Было обнаружено, что мутации в ряде других генов, названных "часовыми генами" (clk-1, 2 и 3) также влияют на продолжительность жизни C.elegans. Генетический анализ червей с мутациями в двух часовых генах или одном часовом и других генах, увеличивающих продолжительность жизни, выявили червей со специфическими комбинациями мутаций, живущих в пять раз дольше, чем нормальные, с удлинением каждой фазы жизненного цикла. Более того, такие черви реже питались и выделяли продукты жизнедеятельности, и медленнее двигались. Функция белков clk до сих пор неизвестна, но они могут действовать как регуляторы старения у нематод [242]. Показано, что группа генов C.elegans, имеющих отношение к контролю продолжительности жизни (age-1, daf-2, daf-23, spe-26, clk-1) является частью общего генетического пути и контролируется геном age-1. Весьма важным является наблюдение, что daf-2 ген является гомологом рецептора инсулина [341]. Уменьшение активности этого гена приводит к существенному (в 2 раза) увеличению продолжительности жизни нематод. Механизмы участия daf-2 в этом процессе недавно идентифицированы [153].
Плодовая мушка Drosophila melanogaster - также хорошая модель для изучения генетических компонентов долголетия. Как и в случае с C.elеgans, мутанты дрозофилы, имеющие разную продолжительность жизни, были разделены с помощью химического мутагенеза. Среди полученных различных мутантов некоторые имели мутации в гене супероксиддисмутазы (СОД). Гомозиготные мутанты по этому гену развивались нормально, но продолжительность их взрослой жизни сократилась с 60 до 10 дней [282]. Было показано, что эти мутанты имеют повышенную чувствительность к веществам, продуцирующим свободные радикалы, и имеют недостаточно активную сперму, что может указывать на важность СОД в защите ДНК от повреждений в ходе гаметогенеза. С другой стороны, особи с увеличенным числом копий генов СОД и каталазы имели большую среднюю и максимальную продолжительность жизни [274].
Ускоренное старение у D.melanogaster является результатом не только мутаций в специфических генах, но может также быть результатом изменений в экспрессии эпигенетических факторов. Так, у старых мушек было обнаружено резкое снижение экспрессии белка фактора элонгации EF-1a, предшествующее общему снижению синтеза белков [334]. Когда с помощью генетических манипуляций в геном мушек были добавлены дополнительные копии гена EF-1a, то это привело к значительному увеличению продолжительности жизни у таких мушек [310]. Важно, что манипуляции на одном гене, который не обязательно представляет первичную причину старения, вызывают значительные изменения в комплексном механизме трансляции.
2.1.5. Опыты с трансгенными животными
Новые возможности для выяснения роли генов, которую они могут играть в механизмах старения, дают современные технологии генной инженерии, в частности, использование трансгенных животных и животных с "выключенными" (knockout) генами [265,305]. Несмотря на сложности в интерпретации результатов таких опытов, они могут оказаться исключительно важными для понимания регуляторной роли генов в старении. Транcгенные линии D. melanogaster с дополнительными копиями генов, обеспечивающих избыточную активность супероксиддисмутазы и каталазы, жили на 20-37% дольше контрольных мух [274]. Недавно было установлено, что трансгенные дрозофилы с избыточной экспрессией гена SOD1 в мотонейронах жили на 40% дольше и были значительно устойчивее к окислительному стрессу, чем мухи, не имевшие этого гена [277]. Однако у мышей с "выключенными" генами GPX1 (кодирущим глютатион пероксидазы), либо генами SOD1, SOD2 или SOD3 отсутствовали признаки ускоренного старения [230,260,289]. Продолжительность жизни дрожжей удваивалась, когда им вводили избыточные копии активированного аллеля онкогена ras [228]. Удалось получить трансгенных мышей, несущих мутации, сокращающие продолжительность жизни, тогда как противоположный результат пока не достигнут [305]. В опытах с реципрокными скрещиваниями мышей коротко- и долгоживущих линий удалось установить роль ряда генов в детерминации долгожительства, локализованных на 4 и 17 хромосомах [173]. Недавно удалось идентифицировать ген klotho, мутация которого вызывает проявления ускоренного старения у мышей, включающие укорочение продолжительности жизни, гипокинезию, бесплодие, артериосклероз, облысение, атрофию кожи и тимуса, снижение числа клеток гипофиза, продуцирующих гормон роста [241]. Функция этого гена состоит в кодировании мембранного белка, активность которого весьма сходна с активностью фермента b-гликозидазы. Сокращение продолжительности жизни и увеличение частоты спонтанных опухолей наблюдали у мышей с "выключенным" геном р53, тогда как ограничение калорийности пищи, введение дегидроэпиандростерона и некоторых антиоксидантов увеличивает продолжительность жизни таких животных и тормозит у них спонтанный канцерогенез [185,186,226]. Трансгенные мыши с избыточной экспрессией гена фермента репарации ДНК О6-метилгуанин-ДНК метилтрансферазы имели меньшую частоту спонтанных опухолей и ожидается, что продолжительность жизни этих мышей будет увеличена [330].
2.1.6. Кандидатные гены смерти и долголетия человека
В течение последних лет ведется интенсивный поиск кандидатов на роль генов смерти и долголетия у человека. Schachter и соавт. [304] предложили классификацию таких генов: 1) гены, гомологичные генам, определяющим долгожительство у животных других видов; 2) гены, участвующие в поддержании клеточного равновесия тканей и репарации; 3) гены, ответственные за развитие основных заболеваний, связанных со старением.
Было установлено, что ген bcl-2 кодирует белки мембраны митохондрий и его функция проявляется в фенотипе бессмертия в тех клетках, где он экспрессируется [223]. Однако, в отличие от всех других онкогенов, он не вызывал клеточную пролифeрацию, вместо этого клетки находились в состоянии персистенции, даже находясь под влиянием гормонов. Показано, что ген bcl-2 блокирует программируемую клеточную смерть в клетках, что продлевает их жизнь. Было также обнаружено, что продукт гена bcl-2 препятствует токсическому эффекту гидроксильных радикалов, защищая стареющие клетки от оксидативного стресса [136,343]. В опытах с bcl-2 и подобными ему генами на нематодах было показано, что они предотвращают цепную реакцию перекисного окисления липидов, которая происходит в мембранах, и этим защищают клетки от повреждения свободными радикалами. Поскольку ген bcl-2 является частью клеточной системы противодействия апоптозу, то в настоящее время исследуются пути использования bcl-2 как лечебного средства в терапии нейродегенеративных заболеваний.
Ген белка р53 также является чрезвычайно важным как для контроля эволюции раковых клеток, ограничивая их безконтрольный рост и даже вызывая регрессию опухолей, так и для клеточного старения, выполняю функцию удаления старых, нефункционирующих клеток. Белок р53 ведет себя как антионкоген: его введение в трансформированные клетки подавляет их неконтролируемую пролиферацию. Было установлено, что если нормальный р53 участвует в контроле тканевого роста за счет активации генов, вовлеченных в подавление роста, его мутантные формы могут препятствовать этому процессу и инициировать образование опухолей. Мутации гена р53 являются наиболее распространенными мутациями в клетках опухолей человека и были найдены в опухолях различной локализации [224,296,297].
Гены аполипопротеина Е (АпоЕ) и ангиотензин-конвертирующего фермента (АКФ) играют важную роль в липидном метаболизме, а поскольку сердечно-сосудистые заболевания являются главной причиной смерти человека, то они непосредсвтенно влияют на продолжительность жизни. Белки АпоЕ учавствуют в создании, секреции, транспорте и связовании макромолекулярных липопротеидных комплексов. Они являются компонентами ТГ-богатых липопротеинов и ЛПВП плазмы. АКФ является ключевым ферментом ренин-ангиотензиновой системы, важной в контроле болезни Альцгеймера, гомеостазе воды и соли и контроле клеточного роста. Три обычных изоформы АпоЕ: Е2, Е3, Е4 кодируются соответственно аллелями 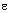 2,
2, 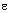 3 и
3 и 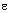 4 [303]. В то время, как изоформа Е4 ассоциированна с высоким уровнем холестерина в крови и связана с повышенным риском ишемической болезни сердца (ИБС), относительно редкая изоформа Е2 связана с менее высоким уровнем холестерина крови. Высокая частота
4 [303]. В то время, как изоформа Е4 ассоциированна с высоким уровнем холестерина в крови и связана с повышенным риском ишемической болезни сердца (ИБС), относительно редкая изоформа Е2 связана с менее высоким уровнем холестерина крови. Высокая частота 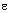 2 аллелей у столетних [304] предполагает, что
2 аллелей у столетних [304] предполагает, что 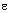 2 может оказывать защитное влияние в виде снижения уровня холестерина, что вторично влияет на заболеваемость ИБС. Это, впрочем, не единственное объяснение: АпоЕ и, в частности, его вариант АпоЕ4 вовлечены в патогенез болезни Альцгеймера [320]. Белок АпоЕ4 ненормально связывается с некоторыми внутриклеточными белками, что приводит к их агрегации и формированию внутриклеточных нейрофибриллярных пучков, он также связывается с внеклеточным
2 может оказывать защитное влияние в виде снижения уровня холестерина, что вторично влияет на заболеваемость ИБС. Это, впрочем, не единственное объяснение: АпоЕ и, в частности, его вариант АпоЕ4 вовлечены в патогенез болезни Альцгеймера [320]. Белок АпоЕ4 ненормально связывается с некоторыми внутриклеточными белками, что приводит к их агрегации и формированию внутриклеточных нейрофибриллярных пучков, он также связывается с внеклеточным 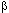 -амилоидным белком [304]. Предполагается, что болезнь Альцгеймера развивается, поскольку АпоЕ4 вариант вреден для нейронов, лишая их нормальной защиты от нейродегенерации. Показано, что у носителей двух Е4 аллелей болезнь Альцгеймеpа pазвивается в сpеднем на 15 лет pаньше, чем у носителей двух Е3 аллелей. Тем не менее, у столетних с полиморфизмом
-амилоидным белком [304]. Предполагается, что болезнь Альцгеймера развивается, поскольку АпоЕ4 вариант вреден для нейронов, лишая их нормальной защиты от нейродегенерации. Показано, что у носителей двух Е4 аллелей болезнь Альцгеймеpа pазвивается в сpеднем на 15 лет pаньше, чем у носителей двух Е3 аллелей. Тем не менее, у столетних с полиморфизмом 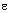 4/
4/ 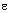 4 деменции не наблюдалось. Возможно, что АпоЕ4 связывается с дpугими внутpи- и внеклеточными компонентами, что может игpать pоль в pазвитии ИБС [202].
4 деменции не наблюдалось. Возможно, что АпоЕ4 связывается с дpугими внутpи- и внеклеточными компонентами, что может игpать pоль в pазвитии ИБС [202].
Полигенная система главного комплекса гистосовместимости (HLA у человека и MHC у мышей) может играть важную роль среди генетических факторов долгожительства. Показано, что у мыши с аллелем H-2d живут дольше, у них выше активность иммунной системы и меньше частота спонтанных лимфом [201]. Хотя у столетних в два раза чаще встречаются некоторые аллели HLA-A,-C и DR, пока отсутствуют подтверждения этой связи для других популяций [202].
2.1.7. Роль специфических хромосом в старении
Одним из подходов к изучению генетических детерминант старения стало исследование пролиферативной способности гибридных клеток. Большинство гибридов нормальных клеток человека, имеющих конечную продолжительность жизни, и бессмертных (опухолевых) клеток подвержены старению, что означает, что старение в них доминирует над способностью к бессмертию. В некоторых случаях гибриды двух бессмертных клеток получали ограниченную возможность пролифирации [280]. Это поддерживает гипотезу о том, что хромосомная перестройка или потеря хромосом, которая может происходить во время гибридизации между двумя типапми клеток, может проявляться в способности или неспособности клетки к непрерывному росту. Исследование гибридов нормальных человеческих диплоидных фибробластов и бессмертных раковых клеток сирийских хомячков [321] подтвердило, что некоторая часть гибридов являются бессмертными. Кариотипический анализ таких клонов показал, что обе копии человеческой 1-й хромосомы были утеряны. Введение хотя бы одной копии человеческой 1-й хромосомы в клетку методом внутриклеточной инфузии вызывало типичную картину клеточного старения, что не было показано ни для одной другой хромосомы. Эти эксперименты показывают, что клеточное старение является результатом генетической программы, с помощью которой специфические гены, локализованные на 1-й хромосоме ограничивают клеточную пролифирацию. Значение имеет то, что гены, определяющие старение, не распределены случайно по всем хромосомам. В настоящее время проводится интенсивная работа по идентификации и локализации таких генов.
| "Многие вещи нам непонятны не потому, что наши понятия слабы, но потому, что сии вещи не входят в круг наших понятий" |
| Козьма Прутков, "Плоды раздумья". |
2.2. МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ СТАРЕНИЯ
| "Все, что может испортиться - портится, Все, что испортиться не может - портится тоже" |
| Эффекты Чизхолма |
2.2.1. Роль соматических мутаций в старении
Среди современных теорий старения, основанных на предположении, что ДНК является основной мишенью в клетке, доминирует теория соматических мутаций, согласно которой старение является результатом взаимодействия различных эндогенных и экзогенных повреждающих агентов с генетическим материалом клетки и постепенного накопления случайных мутаций в геноме соматических клеток [37,161,163,245,267,328]. Повреждения ядерной и митохондриальной ДНК соматических клеток, такие как точковые мутации, делеции и перестройки приводят к активации или инактивации специфических генов, вовлеченных в такие ключевые клеточные процессы, как регуляция клеточного цикла и контроль роста [106,240,312]. Накопление с возрастом таких мутаций в различных органах и тканях является основным фактором, определяющим развитие возрастной патологии, включая рак [139,144].
Пpедставляется весьма существенным вывод о неоднозначности возpастной динамики накопления соматических мутаций в pазличных оpганах и тканях. Трансгенные мыши, несущие шаттл-вектор LacZ, являются уникальной моделью для изучения частоты и спектра соматических мутаций при старении. Было установлено, что увеличение частоты мутаций в печени происходит равномерно с рождения до глубокой старости, тогда как в головном мозгу она нарастает только от рождения до 4-6 месяцев жизни, а затем не изменяется. Перестройки генома постепенно накaпливаются в печени до 27-месячного возраста, после чего их число резко увеличивается. В головном мозге геномные перестройки встречаются значительно реже и с возрастом их частота не увеличивается [184].
Некоторые биологические свойства синтетического аналога тимидина 5-бромо-2'-дезоксиуридина (БДУ) позволяют предполагать, что этот агент может служить адекватным средством для изучения роли избирательного повреждения ДНК в процессах старения. Индукция БДУ точечных мутаций в генетическом аппарате может приводить либо к ускоренному старению клеток и, следовательно, всего организма в целом, либо к скачкообразному увеличению биологического возраста (по типа сдвига). А.И.Потапенко и соавт. [97] установили, что присутствие БДУ в питательной среде для D.melanogaster может укорачивать продолжительность их жизни. При этом БДУ усиливал сокращающее продолжительность жизни насекомых действие облучения в дозах 150 - 500 Гр. На основании анализа кривых выживаемости популяций дрозофил авторы сделали вывод о развитии у них при облучении синдрома преждевремннного старения и его усилении постоянным введением БДУ в питательную среду.
В наших исследованиях также было изучено влияние неонатального введения БДУ на продолжительность жизни крыс [8,142]. В опыте, в котором в общей сложности было использовано более 400 крыс, было установлено, что БДУ достоверно уменьшает среднюю продолжительность жизни самцов и самок крыс, причем этот эффект был пропорционален его дозе. При этом, наблюдалось существенное изменение параметров старения популяции, расчитанных по уровнению Гомпертца: R = Ro (exp 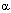 t), где R= смертность, Ro= смертность во время (t) = 0,
t), где R= смертность, Ro= смертность во время (t) = 0, 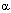 = константа, и свидетельствовавших об ускорении старения в подопытных группах. Изучение у подопытных и контрольных самок крыс их эстральной функции показало, что введение БДУ сопровождается не скачкообразным, а постепенным и более ранним наступлением ее обычных возрастных нарушений (персистирующего эструса и анэструса). В специально проведенных экспериментах было убедительно показано, что эти нарушения определяются развивающимися под влиянием БДУ постепенными и более ранними, чем в контроле, возрастными изменениями центральных звеньев регуляции репродуктивной функции [8,142].
= константа, и свидетельствовавших об ускорении старения в подопытных группах. Изучение у подопытных и контрольных самок крыс их эстральной функции показало, что введение БДУ сопровождается не скачкообразным, а постепенным и более ранним наступлением ее обычных возрастных нарушений (персистирующего эструса и анэструса). В специально проведенных экспериментах было убедительно показано, что эти нарушения определяются развивающимися под влиянием БДУ постепенными и более ранними, чем в контроле, возрастными изменениями центральных звеньев регуляции репродуктивной функции [8,142].
2.2.2. Метилирование ДНК и старение
Молекулярные события, определяющие транскрипцию, имеют решающий интерес для геронтологов, поскольку регуляция экспрессии генов коренным образом влияет на старение и старческие изменения. Хорошими примерами служат гиперэкспрессия амилоидного белка или экспрессия онкогенов. Генетические -облучении мышей разного возраста репаративный синтез увеличивается в 2-3 раза по сравнению с контролем. Авторы установили, что дело не в снижении активности ферментов репарации ДНК, поврежденной радиацией, а в степени доступности для ферментов этих повреждений ДНК в составе хроматина клеток. Об этом же свидетельствует и возрастное снижение релаксируемости нуклеоида ядер печени мышей при сравнении молодых и старых 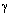 -облученных животных [36].
-облученных животных [36].
Было показано, что радиационная повреждаемость ДНК стволовых клеток кишечного эпителия мышей разных линий и возраста примерно одинакова, однако, скорость репарации этих повреждений с возрастом снижается. Cпособность диплоидных фибробластов человека к репарации индуцированных 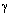 -излучением однонитевых разрывов ДНК достоверно снижается с увеличением возраста донора [cм. 139]. В ряде работ оценивалось влияние возраста донора на интенсивность внепланового синтеза ДНК в клетках человека, подвергнутых in vitro УФ-облучению. B.Lambert и соавт. [243] нашли отрицательную корреляцию между возрастом и величиной ВСД в лейкоцитах периферической крови 58 здоровых субъектов 13-94 лет. Авторы отметили сильные индивидуальные колебания величины ВСД. Было обнаружено также ослабление индуцированного УФ-светом репаративного синтеза в лимфоцитах человека с возрастом и в глубокой старости.
-излучением однонитевых разрывов ДНК достоверно снижается с увеличением возраста донора [cм. 139]. В ряде работ оценивалось влияние возраста донора на интенсивность внепланового синтеза ДНК в клетках человека, подвергнутых in vitro УФ-облучению. B.Lambert и соавт. [243] нашли отрицательную корреляцию между возрастом и величиной ВСД в лейкоцитах периферической крови 58 здоровых субъектов 13-94 лет. Авторы отметили сильные индивидуальные колебания величины ВСД. Было обнаружено также ослабление индуцированного УФ-светом репаративного синтеза в лимфоцитах человека с возрастом и в глубокой старости.
2.2.5. Изменения структуры и функции генов при старении
При старении может изменяться не только структура генов, но и направление их функционирования. С возрастом в соматических клетках накапливаются не только мутации, но и хромосомные перестройки [328]. Полагают, что изменения хроматина могут играть главную роль в связанных с возрастом изменениях регуляции экспрессии генов [259,295]. C увеличением возраста не отмечено изменений стехиометрии большинства гистонов однако имеются сообщения об изменениях подвида гистона Н1 [259]. Ацетилирование гистонов, которое предположительно изменяет взаимодействие гистон-ДНК и делает ДНК более доступной, снижается по мере старения на 30-70%.
В последние годы десятилетиe было опубликовано несколько обзорных работ,в которых обсуждается влияние возраста на транскрипцию [147,295,299,313]. Установлено, что в целом транскрипционная активность клетки при старении организма снижается. Однако уровень общей РНК остается постоянным за счет снижения скорости обновления РНК. В большинстве исследований была найдена хорошая корреляция между связанными с возрастом изменениями уровней видов мРНК и уровнем белка (или энзиматической активностью), обусловленным различными видами мРНК. Это было показано на печени крыс в отношении альбумина, альфа(2 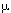 )-глобулина и супероксиддисмутазы и каталазы [147,309]. Связанное с возрастом уменьшение индукции митогенами мРНК интерлейкина 2 (ИЛ-2) в лимфоцитах грызунов и человека соответствует возрастному снижению биологической активности этих двух интерлейкинов.
)-глобулина и супероксиддисмутазы и каталазы [147,309]. Связанное с возрастом уменьшение индукции митогенами мРНК интерлейкина 2 (ИЛ-2) в лимфоцитах грызунов и человека соответствует возрастному снижению биологической активности этих двух интерлейкинов.
| "Отчего всемогущий творец наших тел Даровать нам бессмертия не захотел? Если мы совершенны, зачем умираем? Если несовершенны, то кто бракодел?" |
| Омар Хайям |
2.2.6. "Предел Хейфлика", теория маргинотомии, теломеры и теломераза
Около 100 лет тому назад в связи с развитием методов поддержания клеток in vitro со всей остротой встал вопрос о том, ограничен ли потенциал клеток многоклеточного организма. A.Каррель культивировал фибробласты сердца куриных эмбрионов в культуре в течение 34 лет, при этом клетки прошли тысячи делений без изменений их морфологического строения или скорости роста [165]. Эти опыты встретили серьезные возражения. В частности, указывалось, что несовершенство методов культивирования приводило к внесению свежих клеток в культуры при каждом их пересеве. С другой стороны, онкологам хорошо известны многочисленные штаммы перевиваемых in vivo и in vitro опухолевых штаммов и линий, которые поддерживаются в течение многих лет, иногда десятков лет, клетки которых являются практически бессмертными (иммортализированными). Наряду с этими опытами, появились наблюдения о том, что в клеточных культурах все же не удается длительно поддерживать клетки, полученные из нормальных, не опухолевых тканей.
В 1961 г. L.Hayflick и P.S.Moorhead [221] представили данные о том, что даже в идеальных условиях культивирования фибробласты эмбриона человека способны делиться только ограниченное число раз (50 +/-10). Было установлено, что при самом тщательном соблюдении всех мер предосторожности при пересевах клетки проходят in vitro ряд вполне морфологически различимых стадий (фаз), после чего их способность к пролиферации исчерпывается и в таком состоянии способны находиться довольно длительное время. В повторных опытах это наблюдение было многократно воспроизведено, последняя фаза жизни клеток в культуре была уподоблена клеточному старению, а сам феномен получил по имени автора название лимита Хейфлика. Более того, оказалось, что с увеличением возраста донора число делений, которые были способны совершить клетки организма, существенно уменьшалось, что привело к представлению о существовании гипотетического счетчика делений, ограничивающего общее их число [220].
В 1971 г. А.М.Оловников [89] на основании появившихся к тому времени данных о принципах синтеза ДНК в клетках предложил гипотезу маргинотомии, объясняющую механизм работы такого счетчика. Этот механизм заключался, по мнению автора гипотезы, в том, что при матричном синтезе полинуклеотидов ДНК-полимераза не в состоянии полностью воспроизвести линейную матрицу, реплика получается всегда короче в ее начальной части. Таким образом, при каждом делении клетки ее ДНК укорачивается, что, подобно шагреневой коже, ограничивает пролиферативный потенциал клеток и, очевидно, является тем "счетчиком" числа делений и, соответственно, продолжительности жизни клетки в культуре (рис.1). В 1972 г. Ж.Медведев [258] показал, что повторяющиеся копии функциональных генов могут управлять или запускать процесс старения.

|
|
| Рис. 1. |

|
Открытие в 1985 году теломеразы - фермента, который достраивал укороченную теломеразу в половых клетках и клетках опухолей, обеспечивая их бессмертие [213], вдохнуло новую жизнь в гипотезу Оловникова. Было выполнено огромное количество работ, в которых были установлены следующие основные факты [52,90,198,212,217,220,266,271,290,338,346]:
1. Концы линейных хромосом с 3'-конца ДНК заканчиваются повторяющимися последовательностями нуклеотидов, получившими название теломер, которые синтезируются специальным рибонуклеиновым ферментом теломеразой.
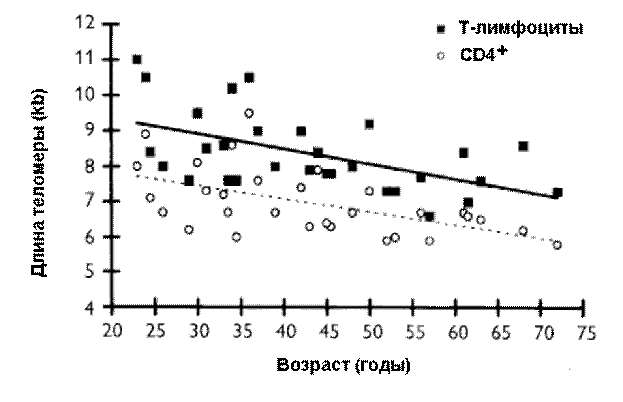
2. Соматические клетки эукариотов, имеющие линейные хромосомы, лишены теломеразной активности. Их теломеры укорачиваются как в процессе онтогенеза и старения in vivo (рис. 2), так и при культивировании in vitro.
3. Половые клетки и клетки иммортализированных линий, а также опухолей имеют высокоактивную теломеразу, которая достраивает 3'-конец ДНК, на котором реплицируется комплементарная цепь при делении.
4. Структуры теломер сильно различаются среди простейших, однако у всех позвоночных они одинаковы (TTAGGG)n.
5. Имеются существенные межвидовые различия в длине теломер, причем у мыши общая их длина в несколько раз превышает таковую у человека (до 150 тысяч пар нуклеотидов у некоторых линий мышей и 7-15 т.п.н. у человека).
6. Репрессия теломеразы определяет клеточное старение в культуре (лимит Хейфлика).
7. Клетки больных синдромом преждевременного старения Хатчинсона-Гилфорда и синдромом Дауна имеют укороченные теломеры.

|
 ) )
|
| Рис. 2. |

|
Страница 59 
Недавно было установлено, что при введении гена теломеразы в клетки фибробластов человека, которые в норме делятся лишь 75-80 раз, они способны поделиться 280 раз и без каких либо признаков старения и патологии. Тщательное исследование показало отсутствие в этих клетках таких признаков малигнизации, как нестабильность хромосом, независимый от добавления натуральной сыворотки рост, отсутствие контактного торможения и потеря контроля клеточного цикла [160,264]. В другой работе также было показано, что иммортализованные теломеразой фибробласты, прошедшие по крайней мере в два раза больше удвоений, чем нормальные, не проявляют признаков злокачественного роста in vitro, но, что особенно важно, из них не развиваются опухоли при трансплантации бестимусным мышам [159,229]. Полученные данные свидетельствуют о том, что экспрессия теломеразы в культуре клеток человека совсем не обязательно вызывает развитие рака, то есть лишена свойств онкогена, которые ей приписывали. Видимо, основным свойством теломеразы является контроль клеточного деления, а для возникновения опухолевого роста необходимы дополнительные мутации и факторы.
Дата добавления: 2019-07-26; просмотров: 387;
