Равновесие в гетерогенных системах, произведение растворимости
Примером гетерогенной системы может служить насыщенный раствор
труднорастворимого соединения, находящегося в равновесие с твердой фазой. К труднорастворимым веществам относятся многие электролиты - соли, основания (чаще всего амфотерные), некоторые кислоты
(H2SiO3; β-H2SnO3 и др.). Так, трудно растворимы галогениды
серебра, сульфаты бария и стронция, карбонаты бария и кальция. Сульфиды металлов за исключением сульфидов натрия и аммония
характеризуются очень малой растворимостью. Вследствие малой растворимости раствор труднорастворимого электролита становится насыщенным при очень малых концентрациях растворенного вещества.
Между твердой фазой и раствором электролита устанавливается равновесие, например, AgCl 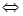 Ag++CI-
Ag++CI-
твердая насыщенный
фаза раствор
В единицу времени в насыщенный раствор переходит сколько ионов, сколько их вновь переходит в осадок. Это состояние равновесия характеризуется величиной константы равновесия
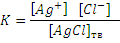
Концентрация твердой фазы – величина постоянная, т.е. [AgCl]тв= const, следовательно [Ag+][Cl-] также величина постоянная, называемая произведением растворимости (ПР): ПРAgCI=[Ag+]∙[CI-].
Таким образом, в насыщенном растворе труднорастворимого соединения произведение концентраций его ионов при данной температуре
есть величина постоянная. При написании ПР необходимо учитывать
стехиометрические коэффициенты в уравнении диссоциации соединения, например: ПРAg2CrO4=[Ag+]2[CrO42-]; ПРAg3PO4=[Ag+]3[PO43-];: ПРAg2S3=[Ag+]2[S2-]3.
В общем виде для системы КmAn↔mkn+ nAn, ПР выразится следующим образом: ПРKmAn=[Kn+]m[Am-]n.
Из понятия ПР вытекает условие образования и растворения осадков. Если =[Kn+]m[Am-]n= ПРKmAn , система находится в равновесии.
Если=[Kn+]m [Am-]n>ПРKmAn или =[Kn+]m [Am-]n<ПРKmAn, система стремится к новому состоянии равновесия, приводящему в первом случав к выпадению осадка, во втором - к его растворению. Эти процессы будут происходить до
тех пор, пока не будут достигнуты ионные концентрации, соответствующие величине произведения растворимости. В таблице 4 приведены
примеры некоторых труднорастворимых веществ.
Таблица 4
Произведение растворимости некоторых труднорастворимых веществ
| Вещество | ПР | Вещество | ПР |
| CuS | 6,3∙10-36 | α- ZnS | 1,6∙10-24 |
| Cu2S | 25∙10-48 | β - ZnS | 2,5∙10-22 |
| HgS | 3∙10-52 | ZnSe | 1∙10-21 |
Физико-химические свойства растворов электролитов.
Примеры решения задач.
Пример 1. Вычисление кажущейся степени диссоциации сильного электролита.
Вычислить степень диссоциации 0,2 М раствора муравьинной кислоты HCOOH, если Кд=2,1∙10-4.
Решение: По закону разбавления α=√(Кд/См) = √(2,1∙10-4/0,2)=3,24∙10-2 или 3,24%.
Пример 2. Вычисление степени диссоциации электролита по осмотическому давлению его раствора.
Рассчитайте кажущуюся степень электролитической диссоциации ZiCIв 0,1 М раствора соли, если раствор изотоничен с 0,19 М раствором сахара С12Н22О11 при 0ºС.
Решение: Моль сахара равен 342 г.
Росм=(mRT)/(M∙V)= (342∙0,19∙8,3144∙273)/ (342∙10-3) = 4,31∙105 Па.
М(ZiCI)=42 г∙моль-1. По осмотическому давлению определяем изотонический коэффициент раствора ZiCI
i=(Pосм∙V)/(nRT)=(4,31∙103∙10-3∙42,39)/(4,239∙8,3144∙273)= 1,19.
Кажущаяся степень диссоциации в 0,1 М ZiCI равна α=(i-1)/(n-1)=(1,9-1)/(2-1)=0,9 или 90 %.
Пример 3. Вычисление степени диссоциации электролита по понижению давление пара растворителя над раствором.
Давление пара водного раствора NaNO3(ω=0 ,08) равно 2268,8 Па при 20 °С. Давление паров воды при этой температуре равно 2337,8 Па. Найдите кажущуюся степень диссоциации нитрата натрия в этом растворе.
Решение. С помощью первого закона Рауля для электролитов вычисляем значение изотонического коэффициента для NaNO3
ι = (P0-P) ∙ (N+n)/P0∙n ;M(NaNO3) = 85,00 г∙моль-1; n=8:85=0,094 моль; М (Н2О)=18,02 г∙моль-1;
ι = (2337,8-2268,9) ∙ (0,094+5,911)/(2337,8∙0,094)=(0,69∙5,199)/219,75 = 1,63.
Кажущаяся степень диссоциации NaNO3 в этом растворе равна
α=(1,63-1)/(2-1) = 0,63 (или 63 %).
Пример 4. Вычисление изотонического коэффициента по повышению температуры кипения раствора.
Раствор, содержащий 8 г NaOH в 1000 г Н2О, кипит при 100,184°С.
Определите изотонический коэффициент (для воды Е =-0,516°С).
Решение. Второй закон Рауля для растворов электролитов выражается уравнением ∆t0кип=ι∙ (Кэ∙100∙m)/(mр-ля∙М(р.в)). Тогда
ι = (∆t0кип∙mр-ля*М(р.в))/(Кэ∙m∙1000)= (0,184∙1000∙40)/(0,516∙1000∙8)=1,78.
Дата добавления: 2019-04-03; просмотров: 549;
