Понижение температуры замерзания и повышение температуры кипения растворов. Второй закон Рауля
Растворы замерзают при более низкой температуре, а кипят при более высокой температуре, чем чистый растворитель. Понижение температуры замерзания и повышение температуры кипения раствора пропорционально моляльно концентрации растворенного вещества(Второй закон Рауля), т.е. ∆toзам=КК∙С; ∆toкип=КЭ∙С; где ∆toзам – понижение температуры замерзания раствора; ∆toкип – повышение температуры кипения раствора; КК – криоскопическая константа; КЭ – эбуллиоскопическая константа; С – моляльная концентрация растворенного вещества.
Если «m» граммов неэлектролита, имеющего молярную массу М, растворены в m граммах растворителя, то закон Рауля для неэлектролитов можно записать в следующем виде: 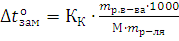 и
и 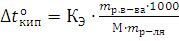
Указанные формулы позволяют находить молярную массу растворенного вещества.
Пример 1. Определение температуры кипения и замерзания раствора неэлектролита.
Определите температуру кипения и замерзания раствора, содержащего 1г нитробензола С6Н5NO2 в 10г бензола. Эбулилиоскопическая и криоскопическая константы бензола соответственно равны 2,57 и 51оС.
Решение. По закону Рауля следует, что
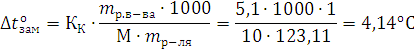
Тогда 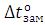 равна
равна 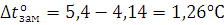
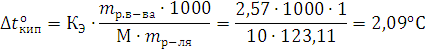
Температура кипения раствора: 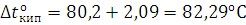 .
.
Пример 2.Вычисление молярной массы неэлектролита по повышению температуры кипения раствора.
Раствор камфоры массой 0,552г в 17г эфира кипит при температуре на 0,461оС выше, чем чистый эфир. Эбулиоскопическая константа эфира 2,16оС. Определите молярную массу камфоры.
Решение. Молярную массу камфоры определяем пользуясь соотношением:
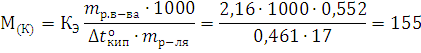
Молярная масса камфоры равна 155,14г∙моль-1.
Пример 3. Вычисление криоскопической константы растворителя. Вычислите криоскопическую константу воды, если водный раствор этилового спирта (ω=0,113) замерзает при -5оС.
Решение. Молярная масса этилового спирта равна 46,07. Из соотношения, проведенного в примере 1, получаем:
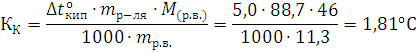
Криоскопическая константа воды КК = 1,81оС.
Пример 4. Вычислите температуры кристаллизации и кипения 2% -ного водного раствора глюкозы.
Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры кипения раствора (∆Т) по сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением
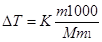 (1)
(1)
где К — криоскопическая или эбулиоскопическая константа. Для воды они соответственно равны 1,86 и 0,52°; т и М — соответственно масса растворенного вещества и его молярная масса; т1 — масса растворителя.
Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим по формуле (1):
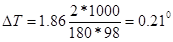
Вода кристаллизуется при 0 С, следовательно, температура кристаллизации раствора 0 - 0,21 = - 0,21 С.
По формуле (1) находим и повышение температуры кипения-2%-ного раствора:
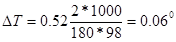
Вода кипит при 100°С, следовательно, температура кипения этого раствора 100 + 0,06 = 100,06°С.
Пример 5.Раствор, содержащий 1,22 г бензойной кислоты С6Н5СООН в 100 г сероуглерода, кипит при 46,529°С. Температура кипения сероуглерода 46,3°С. Вычислите эбулиоскопическую константу сероуглерода.
Решение. Повышение температуры кипения ДТ = 46,529 - 46,3 = = 0,229°. Молярная масса бензойной кислоты 122 г/моль. По формуле (1) находим эбулиоскопическую константу:
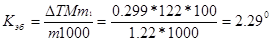
Пример 6.Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислите молярную массу глицерина.
Решение. Температура кристаллизации чистой воды 0 0С, следовательно, понижение температуры кристаллизации ∆Т=
=0 - (-0,279) = 0,2790С . Масса глицерина т (г), приходящаяся на 1000 г воды, равна:
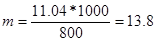
Подставляя в уравнение
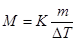 (2)
(2)
числовые значения, вычисляем молярную массу глицерина:
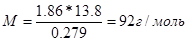
Пример 7. Вычислите массовую долю(%) водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна -0,4650С.
Решение: Температура кристаллизации чистой воды 00С, следовательно ∆Т = 0 – (-0,465) = + 0,4650. Молярная масса мочевины 60 г/моль. Находим массу m (г) растворенного вещества, приходящуюся на 1000г воды, по формуле(2):
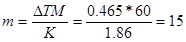
Общая масса раствора, содержащего 15г мочевины, составляет 1000+15=1015г. Процентное содержание мочевины в данном растворе находим из соотношения
В 1015г раствора – 15г вещества
В 100 г раствора – х
х = 1,48%
Дата добавления: 2019-04-03; просмотров: 2341;
