Агонисты и антагонисты глицинового сайта
Для открытия ионного канала, связанного с рецептором NMDA, необходима занятость другого сайта молекулы глицина. Структурные вариации при создании агонистов глицинового сайта достаточно ограничены и заключаются либо в введении заместителей к α‑углеродному атому глицина, либо созданию его конформационно жестких аналогов.
Исследование многочисленных α‑замещенных глицина показали, что введение объемных, и в особенности гидрофобных заместителей, приводит к потере агонистической активности. Уже молекула аланина является слабым агонистом рецепторов NMDA. Тем не менее, введение гидрофильных заместителей, способных выступать в роли акцептора при образовании водородной связи, в некоторых случаях оказывается эффективным.
Соединения этой группы представляют собой производные и аналоги D‑серина. Сам он обладает меньшей агонистической активностью, чем глицин. Исследование структурно жестких аналогов самого глицина показало, что 1‑аминоциклопропанкарбоновая кислота типичный агонист глицинового сайта.
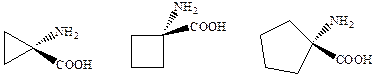
Дальнейшее расширение цикла приводит к потере агонистической активности и аминоциклобутан и аминоциклопентанкарбоновые кислоты становятся наоборот весьма активными антагонистами глицинового сайта. А подавляющее большинство других антагонистов глицинового сайта являются производными кинуреновой кислоты (R = H).
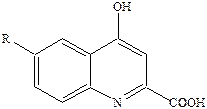
Сама кислота – слабый антагонист, введение R = Cl приводит к повышению антагонистической активности, а введение двух атомов хлора превратит в сильный антагонист.
Введение липофильных заместителей в боковую цепь приводит к повышению антагонистической активности, например, феноксильное производное является одним из самых высоко аффинных и селективных антагонистов глицинового сайта.
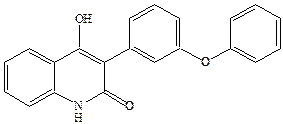
Аффинность – способность вещества связываться с биологической мишенью (в данном случае с рецептором). Численным выражением его служит обратная величина равновесной константы диссоциации комплекса лиганд-рецептор.
Прочность связывания дифенильного соединения с рецептором объясняется наличием дополнительных гидрофобных взаимодействий с феноксильным заместителем.
Таким образом в случае агонистов глицинового сайта все активные соединения содержат α‑аминокислотные группировки, и если α‑углеродный атом хиральный, то предпочтительно D‑конфигурация. Увеличение размеров молекулы либо за счет введения заместителей, либо за счет замыкания глицинового фрагмента в цикл, часто приводит к появлению у соединения антагонистической активности.
Подавляющее большинство антагонистов глицинового сайта действуют по принципу «зонтичного эффекта», т.е. взаимодействуют не только с аминокислотными остатками в сайте связывания глицина, но и соседними аминокислотами, часто соединяющими гидрофобные группы. Учет этих взаимодействий и предопределяет тип структуры антагонистов, которые должны создавать в своем составе как α‑аминокислотную группировку, так и липофильные фрагменты, обеспечивающие дополнительное связывание. Антагонисты глицинового сайта рецепторов NMDA во многих случаях более активны в S‑конфигурации в отличие от агонистов.
Дата добавления: 2019-02-07; просмотров: 797;
