Второй закон термодинамики.
Самопроизвольный процесс, происходящий без изменения энергетического запаса системы совершается только в направлении, при котором энтропия возрастает (S>О);
Австрийским физиком Больцманом было установлено
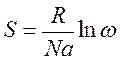
Энтропия - это логарифмическое выражение вероятности существования системы.
R - универсальная газовая постоянная = 8,314 Дж/моль К;
N - постоянная Авогадро ( 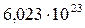 );
);
Следовательно, чем большим числом макрочастиц представлена рассматриваемая макросистема, тем больше вариантов распределение этих частиц, при которых может быть достигнуто макросостояние, тем выше значение энтропии.
1. С повышением температуры энтропия возрастает, так как усиливается неупорядоченность, хаос в системе, т.е.:
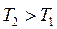 , то
, то 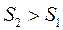
2. Энтропия скачкообразно увеличивается при переходе вещества (кристаллического) в жидкое, т.е. в процессе плавления:
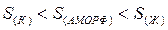
Для веществ в кристаллическом состоянии характерна упорядоченность частиц и наличие ближнего и дальнего порядка. Частицы расположены в строгой последовательности.
Зависимость энтропии от температуры t можно выразить графиком:
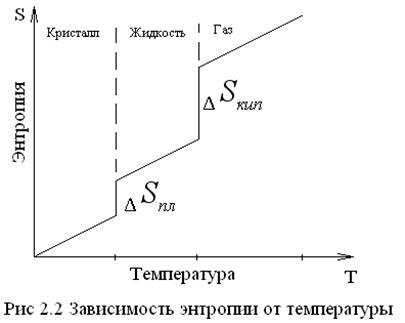
Здесь необходима различать постепенное изменение энтропии ( 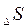 ) за счет изменения параметров состояния (Т) и скачкообразное – в результате фазовых переходов и химических реакций.
) за счет изменения параметров состояния (Т) и скачкообразное – в результате фазовых переходов и химических реакций.
3. Процессы — нагревания, кипения, диссоциации, вызывающие увеличение
беспорядка сопровождаются увеличением энтропии.
4. Кристаллизация, полимеризация связана с уменьшением объема, сопровождаются уменьшением энтропии.
5. Чем тверже вещество, тем меньше его энтропия, чем мягче, тем энтропия больше.
По группам сверху вниз наблюдается увеличение энтропии. В отличие от всех других термодинамических функций энтропия имеет абсолютное значение.
Дата добавления: 2018-11-25; просмотров: 416;
