Химия хлора и его соединений
В природе хлор находится в виде хлоридов. В промышленности хлор получают вместе с водородом и гидроксидом натрия при электролизе водного раствора хлорида натрия:
2NaCl + 2H2O 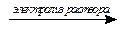 H2 + Cl2 + 2NaOH
H2 + Cl2 + 2NaOH
В лаборатории хлор получают при взаимодействии перманганата калия с концентрированной соляной кислотой:
2KMnO4 + 16HCl ® 2KCl + 2MnCl2 + 5Cl2 + 8H2O
Хлор - тяжелый газ желто-зеленого цвета с резким запахом. Раствор пяти объемов хлора в одном объеме воды называют хлорной водой. Активный окислитель хлор взаимодействует с водородом на свету:
Cl2 + H2 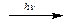 2HCl
2HCl
Хлороводород - бесцветный газ с резким запахом, хорошо растворим в воде: в 1 объеме воды при 0оС растворяется более 500 объемов хлороводорода. Раствор хлороводорода в воде называют хлороводородной соляной кислотой. Это сильная кислота, ее соли - хлориды.
При взаимодействии хлора с водой и щелочами происходит диспропорционирование хлора, и наряду с соляной кислотой образуются кислородосодержащие кислоты хлора или их соответствующие соли:
Cl2 + H2O ® HCl + HClO
2Cl2 + 2Ca(OH)2 ® CaCl2 + Ca(ClO)2 + 2H2O
Смесь хлорида и гипохлорита кальция (CaCl2 + Ca(ClO)2) называют хлорной или белильной известью. Хлор в количестве 1,5 г на 1м3 воды используется для обеззараживания воды. Образующаяся при этом хлорноватистая кислота HClO разлагается с образованием атомарного кислорода (HClO ® HCl + O), который, являясь активным окислителем, убивает микробы, обесцвечивает краски и т.д.
В ряду кислородосодержащих кислот хлора: HClO, HClO2, HClO3, HClO4 - с увеличением степени окисления хлора растет сила кислот, а их окислительная активность уменьшается.
Дата добавления: 2018-11-25; просмотров: 309;
