Термодинамическое условие химического равновесия
Термодинамическим условием равновесия процесса, протекающего в изобарно-изотермических условиях, является равенство нулю изменения энергии Гиббса (DrG(Т)=0). При протекании реакции nаA + nbB = nсC+ ndDизменение стандартной энергии Гиббса равно:
DrG0T =(nc×DfG0C + nd×DfG0D)–(na×DfG0A + nb×DfG0B).
Данное выражение соответствует идеальному процессу, в котором концентрации реагирующих веществ равны единице и неизменны в ходе реакции. В ходе реальных процессов концентрации реагентов меняются: концентрация исходных веществ уменьшается, а продуктов реакции увеличивается. С учетом концентрационной зависимости энергии Гиббса (см. химический потенциал) ее изменение в ходе реакции равно:
DrGT =[nc×(DfG0C + R×T×lnCC) + nd×(DfG0D + R×T×lnCD)]–
– [na×(DfG0A + R×T×lnCA) + nb×(DfG0B + R×T×lnCB)] =
= (nc×DfG0C + nd×DfG0D ) – (na×DfG0A + nb×DfG0B) +
+ R×T×(nc×lnCC + nd×lnCD – na×lnCA – nb×lnCB)
DrGT = DrG0T + R×T× 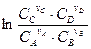 ,
,
где 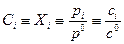 – безразмерная концентрация i-го вещества;
– безразмерная концентрация i-го вещества;
Xi – мольная доля i-го вещества;
pi – парциальное давление i-го вещества; р0 = 1,013×105 Па – стандартное давление;
сi– молярная концентрация i-го вещества; с0 =1 моль/л – стандартная концентрация.
В состоянии равновесия
DrG0T + R×T× 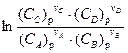 = 0,
= 0,
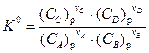 .
.
Величина К0 называется стандартной (термодинамичской) константой равновесия реакции. То есть при определенной температуре Т в результате протекания прямой и обратной реакции в системе устанавливается равновесие при определенных концентрациях реагирующих веществ – равновесных концентрациях (Сi)р. Величины равновесных концентраций определяются значением константы равновесия, которая является функцией температуры, и зависит от энтальпии (DrН0) и энтропии (DrS0) реакции:
DrG0T + R×T×lnK0= 0,
 ,
, 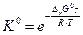 ,
,
поскольку DrG0T =DrН0T – Т×DrS0T,
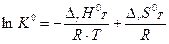 .
.
Если известны величины энтальпии (DrН0T) и энтропии (DrS0T) или DrG0T реакции, то можно вычислить значение стандартной константы равновесия.
Константа равновесия реакции характеризует идеальные газовые смеси и растворы. Межмолекулярные взаимодействия в реальных газах и растворах приводят к отклонению расчетных величин констант равновесия от реальных. Для учета этого вместо парциальных давлений компонентов газовых смесей используется их фугитивность, а вместо концентрации веществ в растворах их активность (см. химический потенциал).
Сдвиг равновесия.
При равновесии в замкнутой системе устанавливаются равновесные концентрации реагирующих веществ. Если в системе изменяется один из параметров термодинамического равновесия (температура, давление, количество взаимодействующих веществ), то система переходит в другое состояние равновесия. Если в результате перехода равновесные концентрации продуктов реакции увеличиваются, то говорят о сдвиге равновесия в прямом направлении (вправо), если увеличиваются равновесные концентрации исходных веществ, то это сдвиг равновесия в обратном направлении (влево).
Определить «направление сдвига равновесия» можно при помощи уравнений изобары и изотермы реакции.
Изобара реакции
Производная lnK0 по температуре при постоянном давлении равна:
 .
.
Данное уравнение называется изобарой реакции. На практике для приближенных расчетов можно считать, что DrН0T » DrН0298, тогда
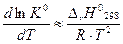 .
.
Если известен знак теплового эффекта реакции, то можно определить «направление сдвига равновесия» при изменении температуры реакционной смеси.
Анализ уравнения изобары.
Пусть в системе протекает реакция
nаA + nbB↔ nсC + ndD.
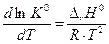 ,
, 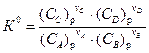 .
.
Поскольку температура и универсальная газовая постоянная величины положительные, то знак производной функции lnK0(T)определяется знаком теплового эффекта реакции.
1. Экзотермическая реакция – DrН0<0. Поскольку производная 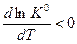 , то функция K(T) убывающая, т. е. с увеличением температуры константа равновесия уменьшается. Следовательно, при возрастании температуры равновесие сдвигается в обратном направлении (уменьшение константы равновесия требует уменьшения числителя и соответственно увеличения знаменателя).
, то функция K(T) убывающая, т. е. с увеличением температуры константа равновесия уменьшается. Следовательно, при возрастании температуры равновесие сдвигается в обратном направлении (уменьшение константы равновесия требует уменьшения числителя и соответственно увеличения знаменателя).
2. Эндотермическая реакция – DrН0>0. Производная 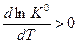 , следовательно, функция K(T) возрастающая, т. е. с увеличением температуры константа равновесия увеличивается. При этом равновесие сдвигается в прямом направлении (увеличение константы равновесия требует увеличения числителя и уменьшения знаменателя).
, следовательно, функция K(T) возрастающая, т. е. с увеличением температуры константа равновесия увеличивается. При этом равновесие сдвигается в прямом направлении (увеличение константы равновесия требует увеличения числителя и уменьшения знаменателя).
Изотерма реакции
Пусть в системе протекает реакция nаA + nbB ↔ nсC + ndD. Если система не находится в состоянии равновесия (DrGT ¹0), то концентрации реагирующих веществ отличны от равновесных. В этом случае изменение энергии Гиббса реакции равно:
DrGT =DrG0T + R×T× 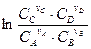 ¹ 0, DrGT =DrG0T + R×T lnKТ×¹0,
¹ 0, DrGT =DrG0T + R×T lnKТ×¹0,
где 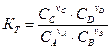 – выражение, построенное по типу константы равновесия, содержащее концентрации реагирующих веществ в системе, не находящейся в состоянии равновесия. Эти концентрации в начальный момент времени являются произвольными и в ходе реакции изменяются до равновесных значений.
– выражение, построенное по типу константы равновесия, содержащее концентрации реагирующих веществ в системе, не находящейся в состоянии равновесия. Эти концентрации в начальный момент времени являются произвольными и в ходе реакции изменяются до равновесных значений.
Поскольку DrG0T + R×T×lnK0=0 ® DrG0T = – R×T×lnK0,
где 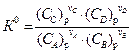 – константа равновесия, то
– константа равновесия, то
DrGT = R×T(lnKТ – lnK0).
Это уравнение называется изотермой реакции. С его помощью можно определить направление протекания химической реакции при постоянной температуре в зависимости от соотношения концентраций реагентов.
Анализ уравнения изотермы.
1. Если соотношение концентраций исходных веществ (A, B) и продуктов (C, D) таково, что KТ = K0,то DrGT = R×T(lnKТ – lnK0)=0. Система находится в состоянии равновесия.
2. Если соотношение исходных концентраций реагентов A, B, C и D таково, что KТ < K0, т. е.концентрация исходных веществ A и B больше равновесной, а концентрация продуктов C и D меньше, то DrGT = R×T(lnKТ – lnK0) <0. Реакция самопроизвольно протекает в прямом направлении. При этом концентрации исходных веществ уменьшаются, а продуктов увеличиваются. Соответственно увеличивается величина KТ. При достижении ею значения K0 система приходит в состояние равновесия (DrGT=0).
3. Если соотношение исходных концентраций реагентов A, B, C и D таково, что KТ > K0, то изменение энергии Гиббса больше нуля. Реакция самопроизвольно протекает в обратном направлении до достижения системой состояния равновесия. При этом концентрации продуктов уменьшаются, а исходных веществ увеличиваются до равновесных значений.
Выводы о влиянии изменения температуры, давления и концентрации реагентов на смещение химического равновесия, сделанные при анализе уравнений изотермы и изобары реакции, находятся в полном соответствии с эмпирическим правилом Ле Шателье (Le Chatelier). Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то смещение равновесия происходит в сторону процесса, ослабляющего эффект внешнего воздействия. Это правило позволяет определять направление смещения равновесия.
Дата добавления: 2017-02-20; просмотров: 4339;
