Классификация аминокислот
По биологической значимости аминокислоты делятся на:
| Заменимые | Незаменимые |
| 1. Глицин 2. Аланин 3. Серин 4. Аспарагиновая кислота 5. Глутаминовая кислота 6. Тирозин 7. Аспарагин 8. Глутамин 9. Пролин 10. Цистеин | 1. Гистидин 2. Изолейцин 3. Лейцин 4. Лизин 5. Метионин 6. Фенилаланин 7. Треонин 8. Триптофон 9. Валин 10. Аргинин |
По строению соединений, получающихся при расщеплении углеродной цепи аминокислоты в организме, различают:
а) глюкопластичные (глюкогенные) – при недостаточном поступлении углеводов или нарушении их превращения они через щавелевоуксусную или фосфоэнолпировиноградную кислоты превращаются в глюкозу или гликоген. К этой группе относятся глицин, аланин, серин, треонин, валин, аспарагиновая и глутаминовая кислота, аргинин, гистидин и метионин:
Глюкопластичные (гликогенные)
Глюкоза Гликоген |
б) кетопластичные (кетогенные) – ускоряют образование кетоновых тел – лейцин, изолейцин, тирозин и фенилаланин (три последние могут быть глюкогенными).
Изолейцин, тирозин и фенилаланин могут быть и глюкогенными.
в) по структуре разделяют на 2 группы:
а. Ациклические – аминокислоты предельного ряда
б. Циклические – аминокислоты ароматического ряда.
А. По количеству функциональных групп различают ациклические аминокислоты:
1) Моноаминомонокарбоновые кислоты:
СН2 – СООН - глицин – участвует в образовании нуклеиновых,
| желчных кислот, гема, необходим для обезвреживания
NH2 в печени токсических веществ.
Аланин – участвует в процессах обмена углеводов и энергии. Его изомер β-аланин является составной частью витамина В5, коэнзима А, экстрактивных веществ мышц.
Серин – входит в состав различных ферментов, основного белка молока – казеина, обнаружен в составе липопротеидов и других белков.
Цистеин – защищает организм при лучевом поражении, при отравлении фосфором.
Метионин – используется для синтеза холина, креатина, тимина, адреналина и др.
2) Моноаминодикарбоновые кислоты:
| СООН СООН | | СН2 СН2 | | СН-NH2 СН2 | | СООН СН-NH2 ↓ | Аспарагиновая кислота СООН ↓ Глутаминовая кислота |
Эти аминокислоты участвуют в биосинтезе белка, образовании тормозных медиаторов (переносчик нервных возбуждений) нервной системы, энергетическом балансе.
3) Диаминомонокарбоновые кислоты:
| NH2-СН2-(СН2)3 – СН-СООН - лизин – участвует в синтезе белка, обнаружен | в составе некоторых ферментов NH2 |
Аргинин - участвует в синтезе мочевины, креатина, который входит в состав мышц и участвует в обмене энергии.
Б. Циклические аминокислоты:
 – СН2 –СН-СООН - фенилаланин – основной источник- | синтеза тирозина – предшественник
NH2 гормонов тироксина, адреналина, некоторых пигментов. – СН2 –СН-СООН - фенилаланин – основной источник- | синтеза тирозина – предшественник
NH2 гормонов тироксина, адреналина, некоторых пигментов.
|
Тирозин – участвует в синтезе адреналина, тироксина.
Триптофан – участвует в синтезе белка, используется для синтеза витамина РР, серотонина, гормонов эпифиза, ряда пигментов.
Гистидин - участвуют в синтезе белка, влияет на кровяное давление, секрецию желудочного сока.
Химические и физико-химические свойства аминокислот обусловлены функциональными группами с противоположными свойствами, поэтому в водном растворе аминокислоты существуют в виде равновесной смеси биполярного иона, катионной и анионной форм молекулы.
NH2- СН2-СООН
аминокислота в водном растворе
NH3+ - СН2-СОО-
Биполярный ион
NH3+ - СН2-СООН NH2 -СН2-СОО- катионная форма анионная форма в кислой среде в щелочной среде |
В кислой области рН молекулы белка несут положительный заряд, в щелочной области – отрицательный заряд. Значение рН, при котором положительный и отрицательный заряд уравновешиваются, т.е. молекула приобретает характер биполярного иона, называют изоэлектрической точкой (рI). При значении рН, равном изоэлектрической точке, аминокислоты не перемещаются в электрическом поле. При рН ниже изоэлектрической точки катион аминокислоты движется к катоду, а при рН выше изоэлектрической точки анион аминокислоты движется к аноду.
катион –
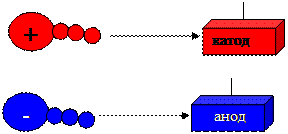
анион
На этом свойстве белков основан анализ их смеси – электрофорез или возможность разделения белков в электрическом поле. В клинико-лабораторной диагностике используется электрофорез белков сыворотки крови.
A
    I I
  +– +–
  Буфер Буфер
|
      В
А α α2 β γ В
А α α2 β γ
|
Аминокислоты, обладая одновременно свойствами слабой кислоты и слабого основания (амфотерные свойства), могут играть роль буферной системы, где могут реагировать как слабая кислота или как слабое основание.
Аминокислоты могут объединяться в длинные цепи, образуя между собой пептидные связи. Две аминокислоты при этом образуют дипептид и т.д. Пептиды содержащие до 10 аминокислот называют олигопептидами, а до 50 -полипептидами, а если больше, чем 50 аминокислот, то уже – белками.
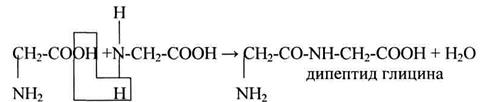
Пептидные связи образуются при взаимодействии α-аминогруппы одной аминокислоты с α-карбоксильной группой другой аминокислоты.
Пептидная связь – амидная ковалентная связь, соединяющая аминокислотные остатки в цепочку. Следовательно, пептиды – это цепочки аминокислот.
Пептидная связь довольно прочная, её можно разорвать, например, путем нагревания раствора белка в присутствии кислоты или щелочи, которые активируют гидролиз этой связи.
Гидролиз пептидной связи в клетках ускоряется при помощи специальных ферментов. Небольшие пептиды в организме присутствуют в незначительных количествах. В последние годы много внимания уделяется изучению структуры и функции пептидов, выполняющих многие важные биологические функции.
Природные пептиды разделяются на несколько групп в зависимости от выполняемых ими функций.
- Группа пептидов, содержащих глутаминовую кислоту, образующих пептидную связь своей γ-карбоксильной группой. Это γ-глутамилпептиды. К этой группе относят глутатион - трипептид (глу-цис-гли), участвующий в окислительно-восстановительных реакциях и обладающий антиоксидантными свойствами (препятствие развитию цепных реакций и свободнорадикальных), необходим для транспорта аминокислот через мембраны эпителия кишечника и почек.
- Пептиды-кинины - регуляторы тонуса сосудов.
- Пептиды-регуляторы функций гипофиза.
- Пептиды-гормоны - инсулин, глюкагон и др.
- Пептиды-нейромедиаторы. Существуют группы нейронов, связанных между собой молекулами - посредниками пептидной природы.
- Нейропептиды секретируются нервными клетками, могут оказывать обезболивающий эффект (энкефалины и эндорфины), модулировать поведенческие реакции.
- Пептиды-антибиотики. Ряд пептидов, образуемых микроорганизмами, используется в медицинской и исследовательской практике в качестве регуляторов механизмов синтеза белка, проницаемости мембран.
- Пептиды-токсины. Из грибов и растений выделено большое число пептидов, вызывающих отравления у человека и животных (пептиды бледной поганки, пептиды насекомых).
Исследование строения и функций биологически активных пептидов позволяет понять многие стороны регуляции процессов жизнедеятельности организмов.
Дата добавления: 2018-03-01; просмотров: 2589;