Кривые ОВ титрования
Кривые ОВ титрования ОВ изображают изменение ОВ потенциала системы по мере приливания раствора титранта.
Редуктометрия, когда раствор окислителя титруется стандартным раствором восстановителя
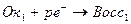
В редуктометрии кривые титрования рассчитывают:
1) 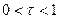
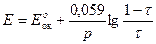
2) 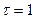
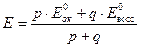
3) 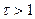
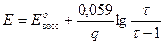
Оксидиметрия, когда раствор восстановителя титруется стандартным раствором окислителя
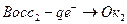 |
В оксидиметрии кривые титрования рассчитывают:
1) 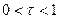
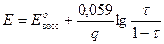
2) 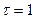
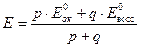
3) 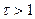
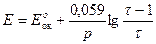
Пример. Рассчитаем кривую титрования 100 см3 раствора FeSO4 c молярной концентрацией эквивалента 0,1 моль/дм3 раствором КMnO4 такой же концентрации.
Уравнение реакции:
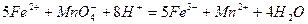
Константа равновесия этой реакции равна
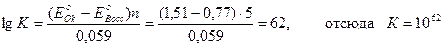
Большое числовое значение константы равновесия показывает, что равновесие реакции практически целиком сдвинуто вправо. После добавления первых же капель титранта в растворе образуются две ОВ пары: 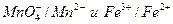 , потенциал каждой из которых можно вычислить по уравнению Нернста:
, потенциал каждой из которых можно вычислить по уравнению Нернста:
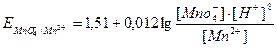
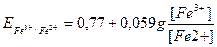
В данном случае раствор восстановителя титруется раствором окислителя, т.е. титрование относится к методу оксидиметрии, расчет кривой титрования проводим по соответствующей схеме.
1) До Т.Э. 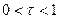
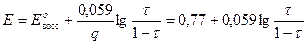
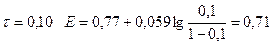
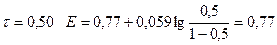
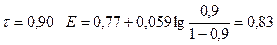
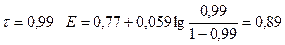
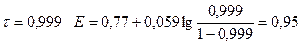
2) В Т.Э. 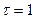
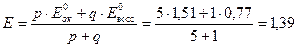
3) После Т.Э. 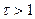
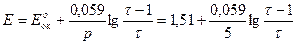
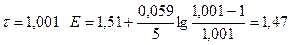
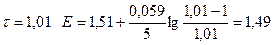
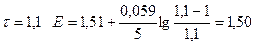
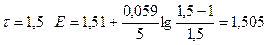
Расчетные данные для построения кривой титрования
| № п/п | τ | Расчетная формула | E, В |
| 0,10 | 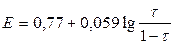
| 0,71 | |
| 0,50 | 0,77 | ||
| 0,90 | 0,83 | ||
| 0,99 | 0,89 | ||
| 0,999 | 0,95 | ||
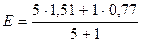
| 1,39 | ||
| 1,001 | 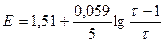
| 1,47 | |
| 1,01 | 1,49 | ||
| 1,10 | 1,50 | ||
| 1,50 | 1,505 |
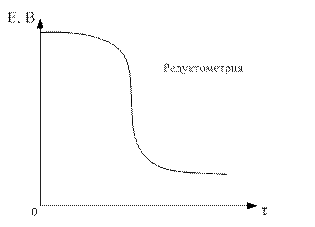
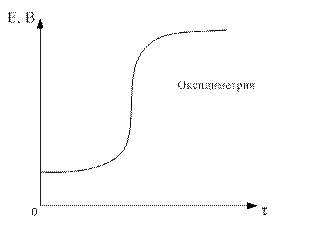
По данным таблицы строим кривую титрования:
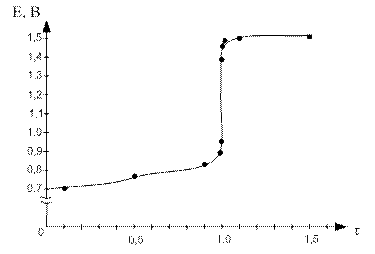
Для ошибки титрования ± 0,1 % скачок титрования
∆E = Eτ=1,001 - Eτ=0,999 = 1,47 – 0,95 = 0,52.
Для ошибки титрования ± 1,0 % скачок титрования
∆E = Eτ=1,01 - Eτ=0,99 = 1,49 – 0,89 = 0,60.
В области ТЭ при переходе от раствора недотитрованного на 0,1 % к раствору перетитрованному на 0,1 % потенциал изменяется больше, чем на 0,5 В. Скачок потенциала позволяет использовать для обнаружения ТЭ непосредственно потенциометрические измерения или ОВ индикаторы, окраска которых изменяется при изменении потенциала. Кроме того в этом случае в качестве титранта используется окрашенный раство, следовательно Т.Э. можно определить по появлению слабо-розовой окраски от одной избыточной капли перманганата калия.
ПЕРМАНГАНАТОМЕТРИЯ
В основе метода лежит окисление растворов восстановителей перманганатом калия КМnО4. Окисление восстановителей можно проводить в различных средах, причем марганец (VII) восстанавливается в кислой среде до ионов Мn2+, в нейтральной - до марганца (IV) и в щелочной - до марганца (VI). Обычно в методе перманганатометрии проводят реакцию в кислой среде. При этом протекает полуреакция
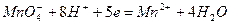
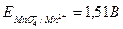
Титрованный раствор 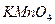 по точной навеске приготовить нельзя, т.к. он содержит в своем составе
по точной навеске приготовить нельзя, т.к. он содержит в своем составе 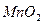 . Поэтому сначала готовят раствор
. Поэтому сначала готовят раствор 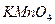 приблизительно нужной концентрации, оставляют в темной бутыли на 7-10 дней, отфильтровывают выпавший в осадок
приблизительно нужной концентрации, оставляют в темной бутыли на 7-10 дней, отфильтровывают выпавший в осадок 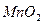 , а затем устанавливают точную концентрацию полученного раствора
, а затем устанавливают точную концентрацию полученного раствора 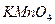 . Стандартизацию раствора
. Стандартизацию раствора 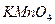 проводят по титрованному раствору щавелевой кислоты (
проводят по титрованному раствору щавелевой кислоты ( 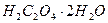 ) или оксалата натрия (
) или оксалата натрия ( 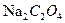 ).
).
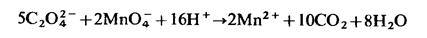
Индикатором служит сам перманганат, окрашенный в красно-фиолетовый цвет. Конец реакции легко определяется по изменению окраски от одной избыточной капли перманганата. В кислой среде титруемый раствор окрашивается в розовый цвет за счет избыточных МnО4- -ионов. Большим недостатком окислительно-восстановительных реакций является их небольшая скорость, что затрудняет процесс титрования. Для ускорения медленно идущих реакций применяют нагревание. Как правило, с повышением температуры на каждые 10° скорость реакции увеличивается в 2-3 раза. Реакцию окисления перманганатом щавелевой кислоты, проводят при температуре 70-80 °С. В этих условиях титрование проходит нормально, так как скорость реакции значительно увеличивается.
Если нагревание применять нельзя (улетучивание одного из веществ, разложение и т. д.), для ускорения реакции увеличивают концентрации реагирующих веществ. На скорость реакции может оказывать влияние введение в раствор катализатора.
Реакцию окисления перманганатом щавелевой кислоты можно каталитически ускорить прибавлением МnSО4, роль которого сводится к следующему:
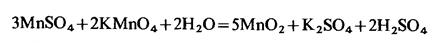
Образовавшийся диоксид марганца окисляет щавелевую кислоту, восстанавливаясь до марганца (III):
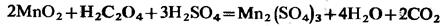
Затем
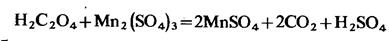
Таким образом, прибавленный к раствору марганец (II) полностью регенерируется и на реакцию не расходуется, но сильно ускоряет реакцию. В перманганатометрии одним из продуктов реакции окисления щавелевой кислоты являются ионы Мn2+, которые по мере образования в растворе ускоряют процесс реакции. Такие реакции называют автокаталитическими. Первые капли перманганата при титровании горячего подкисленного раствора щавелевой кислоты обесцвечиваются медленно. По мере образования небольшого количества ионов Мn2+ дальнейшее обесцвечивание перманганата происходит практически мгновенно, так как образовавшиеся ионы Мn2+ играют роль катализатора.
Дата добавления: 2017-11-04; просмотров: 2024;
