Механизм и кинетика коагуляции золей электролитами
Необходимому для коагуляции сближению частиц дисперсной фазы препятствует, как было показано выше, электростатическое отталкивание имеющих одноименный заряд коллоидных частиц и противоионов и взаимодействие сольватных оболочек противоионов диффузного слоя. При добавлении к золю раствора электролита имеющееся равновесие адсорбции – десорбции между противоионами адсорбционного и диффузного слоев смещается в сторону адсорбции вследствие увеличения в дисперсионной среде концентрации ионов, имеющих заряд, противоположный заряду ядра (ионы с одноименным зарядом в равновесии адсорбции – десорбции не участвуют). Адсорбция дополнительного числа противоионов приводит к уменьшению заряда коллоидных частиц, уменьшению числа противоионов диффузного слоя (уменьшению толщины ДЭС) и, следовательно, к снижению агрегативной устойчивости золя. При достижении некоторого предельного значения заряда коллоидные частицы получают возможность сближения и объединения в более крупные агрегаты за счет ван-дер-ваальсовых сил; иными словами, происходит коагуляция золя.
Очевидно, что, поскольку при адсорбции многозарядных противоионов заряд коллоидной частицы уменьшается быстрее, чем при адсорбции того же числа однозарядных противоионов; адсорбируемость неорганических ионов с увеличением их заряда также возрастает. Следствием этого и является тот факт, что величина порога коагуляции для неорганических ионов будет тем меньше, чем больше заряд иона – коагулянта (величина порога коагуляции γ обратно пропорциональна заряду иона – коагулянта в шестой степени z6).
Процесс коагуляции золя характеризуется определенной величиной скорости коагуляции, которую можно определить как изменение числа коллоидных частиц в единице объема за единицу времени. Скорость коагуляции золя электролитами зависит как от концентрации самого золя, так и от концентрации электролитов. Типичный вид коагуляционной кривой (зависимости отношения концентрации коллоидных частиц n к их начальной концентрации nо от времени t) и кривой зависимости скорости коагуляции V от концентрации электролита С показан на рисунках 4.10-4.11. На кривой ОАБВ (рис. 4.11) отрезок ОА отвечает периоду скрытой коагуляции, при которой золь сохраняет свою устойчивость. В точке А при концентрации электролита С1 начинается явная коагуляция; на участке АБ скорость коагуляции быстро возрастает с ростом концентрации электролита. На участке БВ скорость коагуляции остается постоянной; это связано с тем, что при концентрации электролита С2 величина ζ-потенциала становится равной нулю; скорость коагуляции при этом достигает максимального значения.
|
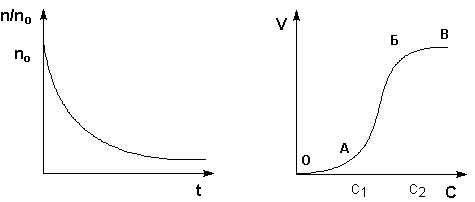
Рис. 4.10 Коагуляционная кривая.
Дата добавления: 2017-09-19; просмотров: 587;
