Третий закон термодинамики
Все вышеприведенные формулы позволяют определить изменение энтропии DS. Абсолютное значение энтропии S вещества можно вычислить, используя постулат Планка, согласно которому энтропия правильно построенного кристалла индивидуального вещества равна нулю при температуре абсолютного нуля (0 К). Этот постулат считается третьим законом термодинамики.
Термодинамические потенциалы.
Функции состояния, изменение которых можно выразить через работу, которые называются термодинамическими потенциалами. Рассмотрим основные из них.
1. Изохорно-изотермический потенциал (свободная энергия Гельмгольца F). Изменение энергии Гельмгольца.
DF = DU – TDS
DF = –DА
DF < 0, самопроизвольный процесс возможен.
2. Изобарно-изотермический потенциал (свободная энергия Гиббса G). Изменение энергии Гиббса:
DG = DU + pDV – TDS
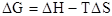
DG = –DА
DG < 0, самопроизвольный процесс возможен.
Задание. Возможен ли термодинамический процесс получения анилина из хлорбензола и аммиака по уравнению
С6H5Cl(ж) + NH3(г) ⇆ С6H5NH2(ж) + HCl(г),
если известны стандартные изменения изобарного потенциала образования веществ, входящих в данную реакцию:
DG0(С6H5Cl) = 198,4 кДж/моль;
DG0(NH3) = –16,63 кДж/моль;
DG0(С6H5NH2) = 153,1 кДж/моль;
DG0(HCl) = –95,28 кДж/моль.
Вычисляем стандартное изменение изобарного потенциала реакции
DG 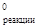 =153,1 –95,28+16,63–198,4= –123,95 кДж.
=153,1 –95,28+16,63–198,4= –123,95 кДж.
Следовательно, процесс возможен.
Изменение энергии Гиббса химической реакции можно рассчитать с использованием значений стандартных энтальпий и энтропий:
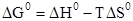 , где
, где 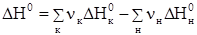 и
и 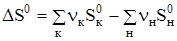 .
.
Задание.Чему равно значение ΔGº при 25ºC (298 К) для реакции:
NiO(тв) + Pb(тв) = Ni(тв) + PbO(тв); ΔHº = 20,4 кДж/моль, если Sº(NiO)=38 Дж/моль•К, Sº(PbO)=66,1 Дж/моль•К?
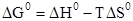 = 12,03 кДж/моль.
= 12,03 кДж/моль.
Растворы
Раствораминазываются гомогенные (однородные) системы переменного состава, состоящие из двух или более компонентов. Размеры частиц в растворах составляют менее 10-8 см. В зависимости от агрегатного состояния растворы могут быть жидкими, твердыми и газообразными.
В каждом растворе должно быть не менее двух компонентов, один из которых называют растворителем, а другие – растворенными веществами. Растворитель – это компонент раствора, находящийся в том же агрегатном состоянии, что и раствор. Часто растворы образуются веществами, находящимися в одинаковых агрегатных состояниях, например спирт (жидкость) и вода (жидкость). В этом случае растворителем может считаться любой компонент, например тот, которого в системе больше.
В зависимости от агрегатного состояния растворителя различают газообразные, жидкие и твердые растворы. Газообразными растворами являются воздух и другие смеси газов. К жидким растворам относят гомогенные смеси, в которых растворенное вещество может быть газом, жидкостью или твердым веществом, а растворитель – жидкостью. Твердыми растворами являются многие сплавы, например, металлов друг с другом, стёкла.
В соответствии с химической теорией растворов, разработанной Д. И. Менделеевым, растворение (при получении жидких растворов) – сложный физико – химический процесс, приводящий к образованию химических соединений (сольватов) между растворителем и растворенными веществами. Для объяснения свойств идеальных растворов с изменением их состава била предложена физическая теория (В.Ф.Алексеев, Вант-Гоффа, Аррениуса и др.) Согласно этой теории, процесс растворения одного вещества в другом является результатом простого распределения молекул по объему тепловым движением, при этом между молекулами проявляются только слабые межмолекулярные взаимодействия.
Общая теория растворов в настоящее время не создана, хотя проводятся широкие научные исследования методами квантовой химии, статистической термодинамики, кристаллохимии, различными физико-химическими методами анализа. Д.И.Менделеев указывал, что образование растворов может рассматриваться с двух сторон: с физической и химической.
Дата добавления: 2017-09-19; просмотров: 590;
