ТРЕТИЙ ЗАКОН ТЕРМОДИНАМИКИ. ТЕПЛОВАЯ ТЕОРИЯ НЕРНСТА
Ранее нами были рассмотрены способы определения внутренней энергии и энтальпии, а также расчеты энергий Гиббса и Гельмгольца. Теперь остановимся на возможности расчета энтропии. Подобная возможность возникает после ознакомления с третьим законом термодинамики. Его следует рассматривать в качестве постулата о предельном значении энтропии и ее изменениях в процессах, происходящих вблизи абсолютного нуля температуры.
Существует несколько формулировок III закона термодинамики:
1. Постулат Планка
Энтропия любого термодинамически равновесного процесса при абсолютном нуле температуры равна нулю;
2. Абсолютный нуль температур не достижим (принцип недостижимости нуля температуры);
3. По мере приблежения к абсолютному нулю значения энтальпии ∆H и энергия ∆G сближаются (тепловая теорема Нернста).
ТЕПЛОВАЯ ТЕОРЕМА НЕРНСТА
Уравнение Гиббса-Гельмгольца:
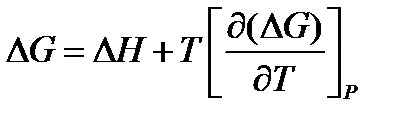
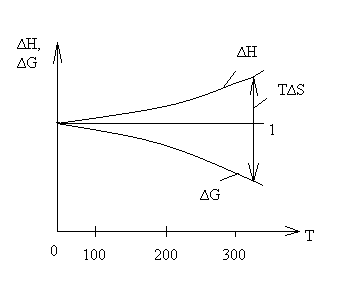
Тепловая теорема Нернста показывает, что по мере приближения к абсолютному нулю происходит сближение между энтальпией ∆Н и энергией Гиббса ∆G, а при абсолютном нуле сближаются кривые, характеризующие изменение ∆Н и ∆G от температуры, и образующаяся общая касательная 1 параллельна оси температуры.
При Т → 0:
1. ∆G =∆H;
2. ∆G =∆H=0;
3. 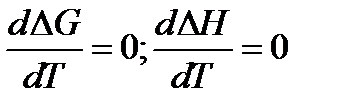
1- Общая касательная
Теорема Нернста: Вблизи абсолютного нуля первая производная по температуре энергии Гиббса равна первой производной изменения энтальпии и равна нулю. 
Следствие:
1. 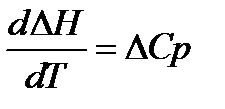 ;
; 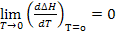
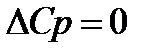
Теплоёмкость вещества при абсолютном нуле температуры равна нулю.
2. 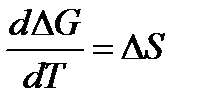 ;
; 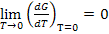
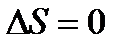
Изменение энтропии при абсолютном нуле температуры равно нулю.
При этом наблюдется так называемое явление «вырождение», когда по мере приближения к абсолютному нулю свойства тел все меньше зависят от температуры.
Обратимся к формуле 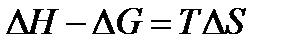 , т.е. в соответствии с тепловой теоремой Нернста разность между кривыми ∆Н и ∆G есть Т∆S. При этом Т → 0 изменение энтропии, согласно 2 следствию теоремы Нернста, становится близким к нулю, и кривые начинают сходиться.
, т.е. в соответствии с тепловой теоремой Нернста разность между кривыми ∆Н и ∆G есть Т∆S. При этом Т → 0 изменение энтропии, согласно 2 следствию теоремы Нернста, становится близким к нулю, и кривые начинают сходиться.
Расширенная формулировка Планка
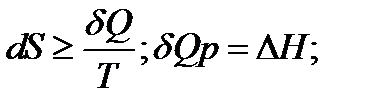
При изменение температуры от Т1 до Т2 изменение энтропии можно выразить следующим образом:
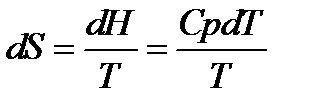
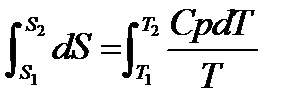 ;
;
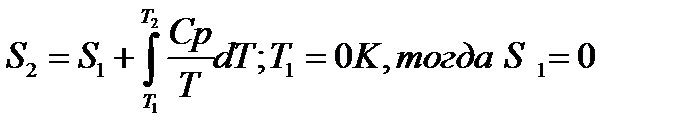
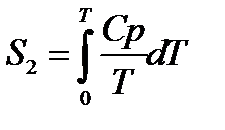
При помощи этого уравнения можно получить абсолютное значение энтропии вещества. Отметим существенное отличие абсолютных значений энтропии от значения других характеристических функций (∆U,∆H,∆G и ∆F), которые являются разностью двух состояний, а не абсолютными значениями.
При абсолютном нуле способность системы к рассеянию энергии иссекает; например, у совершенного
кристалла при абсолютном нуле все атомы находятся в регулярном однородном состояние без разупорядогенности. Они фиксированы в узлах кристаллической решетки и лишены возможности совершать какое - либо движение.
1. Первая строгая формулировка Планка:
Энтропия правильно образованного кристалла при Т=0К равна 0.
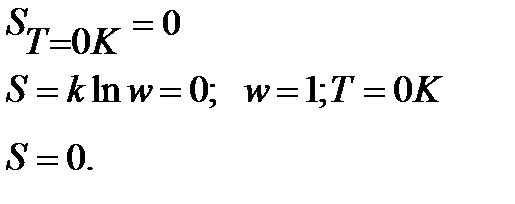
Подчеркнем, что речь идет о правильно образованном, бездефектном, совершенном кристалле. Большинство реальных кристаллов содержат примеси, имеют дефекты, а их энтропия даже при абсолютном нуле несколько больше нуля.
2. Можно показать, что энтропия равна:
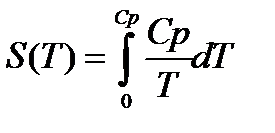
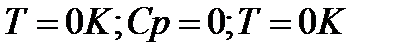
По мере приближения к абсолютному нулю, когда Т→0 , теплоёмкость становиться бесконечно малой величиной и стремится к нулю. Тогда подынтегральное выражение в правой части управления (1) в результате деления двух бесконечно малых величин становится неопределённым, а само уравнение теряет смысл. Из этого в свою очередь вытекает следствие о недостижимости абсолютного нуля температуры. У каждого тела существует своя критическая температура , ниже которой охладить тело невозможно.
РАСЧЕТ АБСОЛЮТНОГО ЗНАЧЕНИЯ ЭНТРОПИИ
Третий закон термодинамики используется для вычисления абсолютных энтропий простых и сложных веществ. Абсолютной энтропией называется энтропия, отсчитанная относительно абсолютного нуля температуры S(0)=0.
Для расчетов необходимо учитывать следующие уравнения.
1. 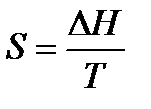
2. 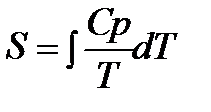
3. 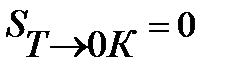
Если вещество может находиться в различных агрегатных состояниях, то следует учитывать изменение энтропии при фазовых переходах. Тогда в общем случае для вещества в газообразном состоянии абсолютная энтропия будет складываться из следующих составляющих:
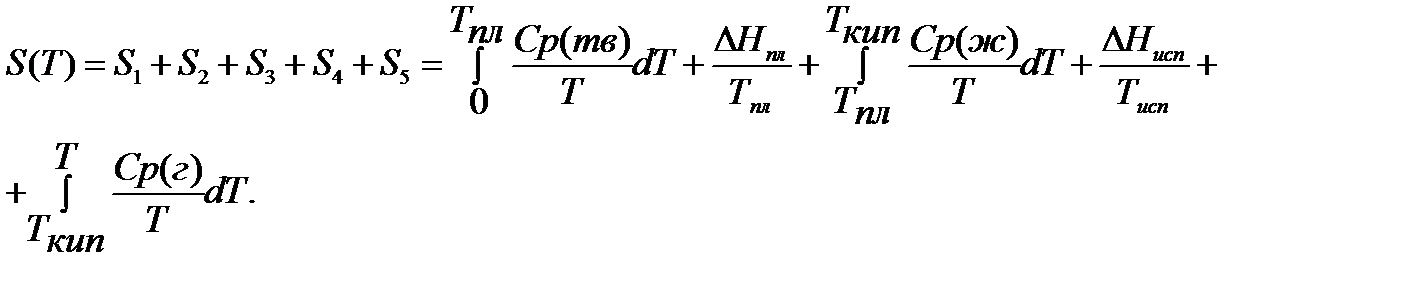
По этому уравнению можно вычислить абсолютные энтропии веществ в твердом, жидком и газообразном состояниях.
Пример. Рассчитать энтропию воды при t=1500C.
Энтропия воды при t=1500C(423К) равна: 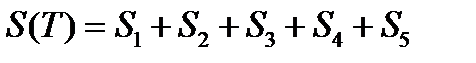
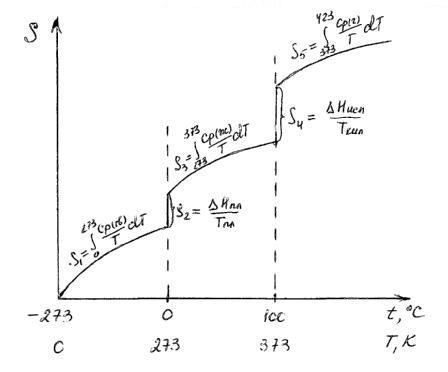
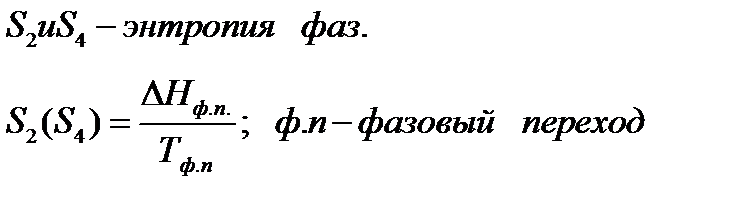
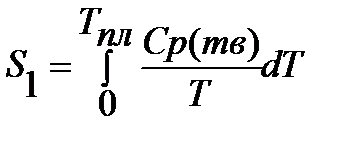 ;
;
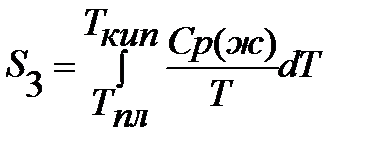 ;
;
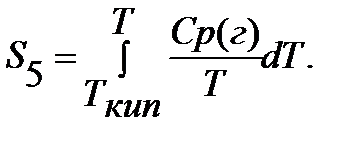
Третий закон термодинамики можно использовать для расчета химических равновесий.
 РАСЧЕТ КОНСТАНТЫ РАВНОВЕСИЯ КР:
РАСЧЕТ КОНСТАНТЫ РАВНОВЕСИЯ КР:
I. По табличным значениям.
II. Интегрирование изобары Вант-Гоффа.
III. Метод комбинированных равновесий.
Дата добавления: 2017-09-19; просмотров: 1057;
