Механизм мышечного сокращения
В первую очередь остановимся на особенностях нервно-мышечного синапса. Этот синапс отличает:
1. Большая поверхность пресинаптической мембраны
2. Синаптическая щель содержит много ГАГ, митохондрий
3. Большая складчатость постсинаптической мембраны
4. Нет суммации – ПКП сразу переходит в ПД
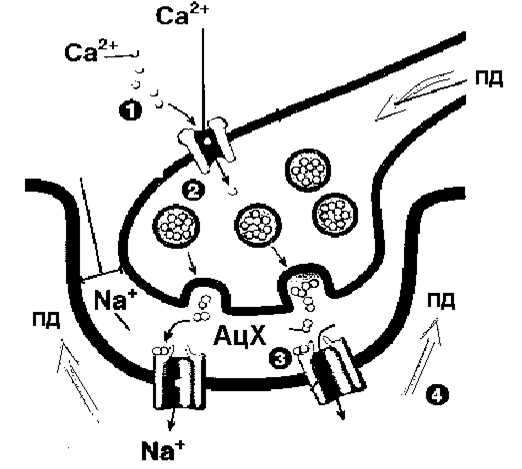
Рисунок 31 Работа нервно-мышечного синапса
Ацетилхолин, который является медиатором в таких синапсах, после синтеза заключается в мембрану и образует гранулы, одна гранула может содержать до 20000 молекул Ах. В покоящемся синапсе постоянно выделяется небольшое количество медиатора, который достигая постсинаптической мембраны вызывает миниатюрные потенциалы в пределах 5 – 10мв. Такие потенциалы поддерживают возбудимость мембраны. При деполяризации пресинаптической мембраны, когда ПД по нервному волокну достигает окончания аксона, медиатор выделяется в синаптическую щель и взаимодействует с холинорецепторами постсинаптической мембраны. Рецепторы представляют собой белковые молекулы, состоящие из 5 субъединиц, расположенных вокруг ионного канала. Активация канала происходит при взаимодействии положительной части молекулы Ах с рецептором, при этом канал открывается и начинает пропускать ионы натрия и калия.
На рисунке 29 представлены этапы генерирования импульса возбуждения в мышечном волокне
1. Распространение ПД по нервному волокну до синаптического окончания. ПД открывает потенциал-зависимые Са++ каналы в терминали аксона (пресинаптическая мембрана). Ионы Са++ поступают в клетку по градиенту концентрации.
2. Ионы Са++ , взаимодействуя со специальными белками – синапсинами, активируют экзоцитоз гранул с медиатором.
3. Ацетилхолин выделяется в синаптическую щель и взаимодействует с никотиновыми холинорецепторами (Н) на мембране мышечного волокна (постсинаптическая мембрана). Избыток медиатора разрушается АХ холинэстеразой до уксусной кислоты и холина. Связывание АХ с рецепторами приводит к открытию каналов для ионов, в результате ион натрия поступает в клетку, происходит деполяризация мембраны и возникает потенциал концевой пластинки (ПКП).
4. Потенциал действия возникает на соседнем участке мембраны в том случае, если разность потенциалов между зарядом мембраны на этом участке и на постсинаптической мембране достигнет критического уровня деполяризации. Как правило, в нервно-мышечных синапсах ПКП всегда превышает КУД и поэтому не требует суммации, а всегда вызывает ПД. ПД быстро распространяется по всему волокну.
Передача команды к сокращению от возбужденной клеточной мембраны к миофибриллам в глубине клетки (электромеханическое сопряжение) включает в себя несколько последовательных процессов, ключевую роль в которых играют ионы Ca++.
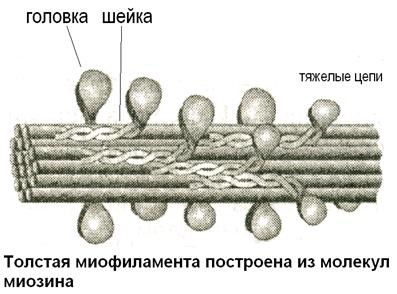
Структурно-функциональная единица миофибриллы мышечного волокна – саркомер- содержит толстые и тонкие миофиламенты. Толстые миофиламенты образованы молекулами миозина, которые имеют четыре легкие цепи миозина и две тяжелые цепи, скрученные между собой. Тяжелые цепи миозина образуют головку миозина и шейку. Головка обладает АТФ-азной активностью, а шейка эластическими свойствами. В толстой филаменте 150 молекул миозина. Под электронным микроскопом на толстой миофиламенте видны выступы, расположенные под углом 120 градусов. Они получили название поперечных мостиков. Выяснилось, что эти мостики образованы головкой и шейкой молекул миозина, их длина 20 нм.
Тонкие миофиламенты построены из глобулярных молекул белка актина. Мономеры актина взаимодействуют между собой и образуют фибриллярный актин. Актиновые филаменты представляют собой закрученную двойную спираль (похоже на две связки бус, которые перекручены с шагом в 14 молекул, примерно 36,5нм). Таких нитей в саркомере 2000. Эти нити одним концом прикреплены к Z- пластинке, а второй конец достигает середины саркомера.
В продольных бороздках актиновой спирали располагаются нитевидные молекулы белка тропомиозина. Тропомиозин закрывает активные центры на актиновых нитях.К молекуле тропомиозина равномерно прикреплены молекулы тропонина. Этот белок может связывать катионы Са++
Актин и миозин – это сократительные белки, а тропонин и тропомиозин – регуляторные.
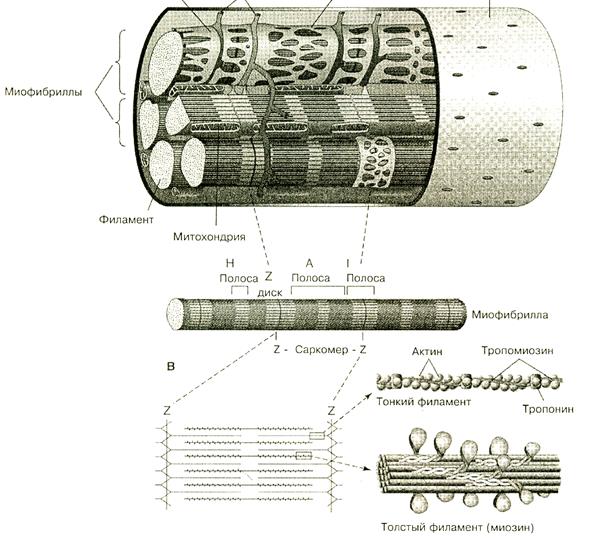
Рисунок 32 Уровни организации скелетной мышцы
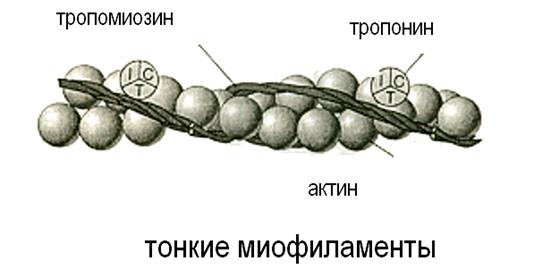
На рисунке 33: а) Тропонин - тропомиозиновый комплекс закрывает активные центры на молекуле актина. б) При повышении концентрации ионов Са++ с 10-8 до 10-5 моль молекула тропонина, чувствительная к Са++, меняет свою форму так, что выталкивает тропомиозин и освобождает активные участки на молекуле актина. Поперечные мостики миозина прикрепляются к актину. б) Головки миозина совершают гребковые движения по направлению к центру саркомера, происходит укорочение мышцы. Обратите внимание на использование энергии АТФ в циклических гребковых движениях.
На рисунке 34 представлен механизм повышения концентрации ионов кальция в цитоплазме и их роль в освобождении активных центров на молекулах актина. В результате становится возможен контакт головки миозина с тонкой миофиламентой. Гребковые движения, которые циклически выполняет головка с шейкой миозина обеспечивают передвижение актиновых нитей относительно миозиновых, сближаются Z- полоски, мышца укорачивается.
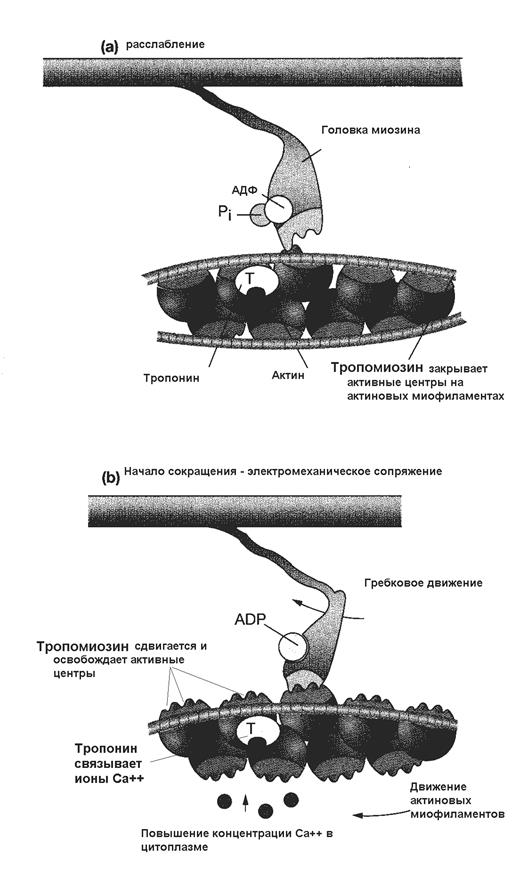
Рисунок 33 Роль регуляторных белков в сокращении мышц
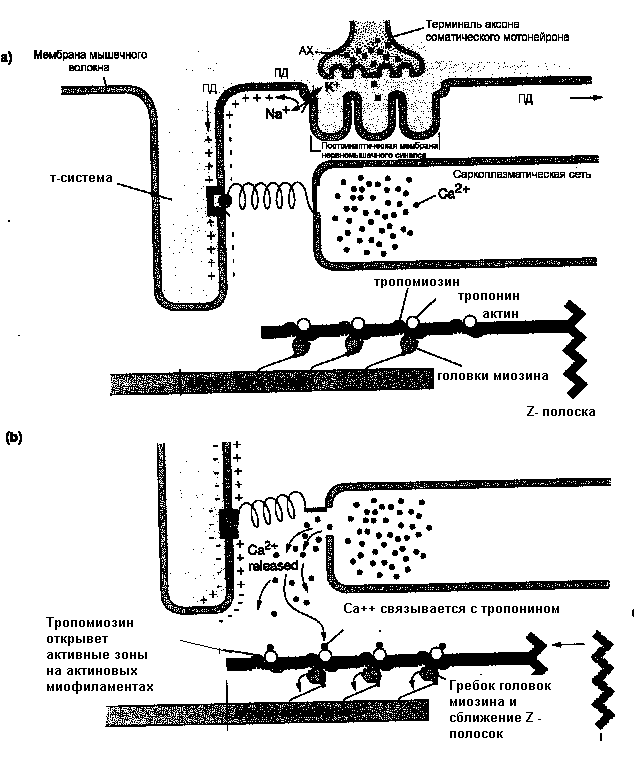
Рисунок 34 Роль кальция в сокращении мышц
Этапы генерирования сокращения.
I) Потенциал действия пресинаптического окончания приводит к выделению медиатора. Кроме деполяризации мембраны пресинаптического волокна в процессе выделения медиатора большую роль играет входящий ток ионов Ca++, который так же вызывается деполяризацией пресинаптической мембраны
II) Возникновение ПКП на постсинаптической мембране.
III) Возникновение ПД - возбуждение мембраны.
IV) Электромеханическое сопряжение:
1) проведение возбуждения по Т-системе,
2) деполяризация мембраны саркоплазматического ретикулума (СПР) и активация кальциевых каналов,
3) высвобождение Ca++ из СПР,
4) взаимодействие Са++ с тропонином актиновых миофиламентов: под влиянием Са++ молекулы тропомиозина глубже опускаются в желобки между цепочками мономеров актина, открывая участки прикрепления для поперечных мостиков миозина,
5) контакт головки миозина с активным центром.
V) Скольжение актиновых миофиламентов относительно миозиновых осуществляется благодаря «гребковым» движениям головок миозина: циклическая активность миозиновых поперечных мостиков с расщеплением АТФ.
VI) Сближение Z полосок и укорочение саркомера.
Дата добавления: 2017-08-01; просмотров: 1537;
