Отличие в свойствах
1. Кислотные свойства более сильные. Степень диссоциации тем выше, чем ближе две группы СООН.
К1 щавелевая = 3,8.10-2
К1 адипиновая = 3,9.10-5
2. Образуют кислые и средние соли, полные и неполные амиды, хлорангидриды, сложные эфиры.
3. Неустойчивы к нагреванию - разлагаются
а) щавелевая и малеиновая кислоты отщепляют СО2 (декарбоксилируются) с образованием одноосновных кислот.
HOOC-COOH  CO2 + HCOOH
CO2 + HCOOH
б) янтарная и глутаровая кислоты образуют циклические ангидриды
O O
CH2-C CH2-C
OH O
OH  H2O + CH2-C
H2O + CH2-C
CH2-C O
O
в) адипиновая кислота и следующие при нагревании отщепляют и СО2, и воду, образуя циклические кетоны.
O
CH2-CH2-C
OH CH2-CH2
OH 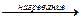 CO2 + H2O + C=O
CO2 + H2O + C=O
CH2-CH2-C CH2-CH2
O циклопентанон
Реакция идет легче, если взять кальциевую соль кислоты (выделяется СаСО3).
4. Двухосновные кислоты, в отличие от одноосновных, могут окисляться.
 O CO2
O CO2
 HO-C=O
HO-C=O 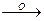 CO2 + HO-C
CO2 + HO-C
HO-C=O OH H2O
5. Малоновая кислота отличается особой подвижностью атомов водорода в метиленовом мостике. Н – приобретает способность замещаться. Например, диэтиловый эфир малоновой кислоты при действии металлического натрия дает замещение Н на Na.
+ 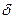 H +
H + 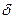
HOOC  C
C  COOH
COOH
H
O O
C C
OC2H5 OC2H5
2CH2 + 2Na  H2
H2  + 2 CHNa
+ 2 CHNa
O O
C C
OC2H5 OC2H5
натриймалоновый эфир
На его основе получают различные кислоты, например,
COOC2H5 COOC2H5
CHNa + Br-CH2-CH3  NaBr + CH-CH2-CH3
NaBr + CH-CH2-CH3 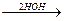
COOC2H5 COOC2H5 -2C2H5OH
O
C
OH
 CH-CH2-CH3
CH-CH2-CH3  CO2 + CH3-CH2-CH2-COOH
CO2 + CH3-CH2-CH2-COOH
O масляная кислота
C
OH
6. Поликонденсация двухосновных кислот с двухатомными спиртами и диаминами
O O O O
nC-(CH2)4-C +n HO-CH2-CH2-OH  n H2O + (-C-(CH2)4-C-O-CH2-CH2-O-)n
n H2O + (-C-(CH2)4-C-O-CH2-CH2-O-)n
HO OH
адипиновая килота этиленгликоль этиленгликольадипинат
O O O O
nC-(CH2)4-C + nH2N-(CH2)6-NH2  nH2O + (-C-(CH2)4-C-NH-(CH2)6-NH-)n
nH2O + (-C-(CH2)4-C-NH-(CH2)6-NH-)n
HO OH
полиамиды (найлон 66)
Дата добавления: 2017-06-02; просмотров: 531;
