Количественное определение
МФ меркуриметрия по индикатору дитизону. Среда щелочная, титрант – нитрат ртути.
Йодометрический метод. Вариант обратного титрования (как ацетилцистеин.
Формы выпуска капсулы, таблетки
НФП Метилметионинсульфония хлорид (витамин U)
Methylmethioninsulfonii chloridum
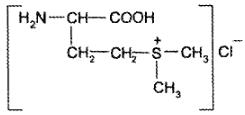
d,l-2-амино-4-(диметилсульфоний)-масляной кислоты хлорид
Описаниебелый или белый со слегка желтоватым оттенком кристаллический порошок со специфическим запахом, сладковато-соленого вкуса. Гигроскопичен. На свету неустойчив. Очень легко растворим в воде, практически нерастворим в спирте.
Подлинность
1. нингридиновая проба «+» - фиолетовое окрашивание
2. при добавлении рейнеката аммония и разведеной хлороводородной кислоты появляется розовый осадок, растворимый в ацетоне (групповая для веществ основного характера)
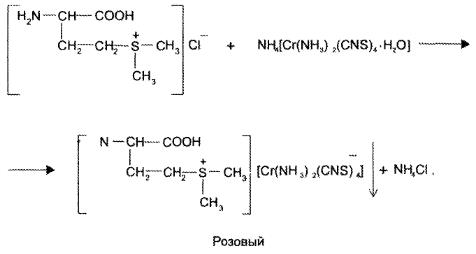
3. реакция на хлорид ионы «+»
4. Т°пл 129-135оС (метод 1а, с разложением)
Чистота
1. раствор должен быть прозрачным и бесцветным
2. рН потенциометрически (4,0-5,3)
3. специфические примеси: d,l--гомосерин и метионин – хроматографически на силикагеле F
Количественное определение
кислотно-основное титрование в среде неводного (протогенного) растворителя - ледяной уксусной кислоты и ацетата ртути (для связывания НCI),
индикатор – кристаллический фиолетовый, титруют до изумрудно-зеленого. Титрант – хлорная кислота.
Суммарно:
[(CH3)2– S+– (СН2)2 – CH – COOH ] Сl-+ НСlO4 → [(CH3)2– S+– R] СlO4- + НСl
│
NH2
Хранениев хорошо укупоренной таре, в защищенном от света месте.
Применениевитамин U, при язвенной болезни ЖКТ.
По чупаку-белоусову
Подлинность
На ион кальция.
ион кальция можно открыть реакцией с оксалатом аммония после подщелачивания раствором аммиака, но образуется только муть (примесь- свободного кальция).
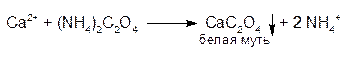
Для доказательства наличия ионов кальция в препарате их надо вытеснить другими ионами из комплекса с ЭДТА, образующими более прочный комплекс. Для этого используют нитрат свинца, но сначала необходимо убедиться в отсутствии примеси ионовPb2+ (мешают открытию Са2+ ) -добавляют раствор калия йодида, не должно появляться желтого осадка йодида свинца:
Pb2+ +2KI → PbI2↓
Константа нестойкости комплекса ЭДТА с ионами кальция больше, чем у ЭДТА с ионами свинца. Следовательно, ионы свинца будут замещать ионы кальция в комплексной соли с образованием более прочного комплекса:
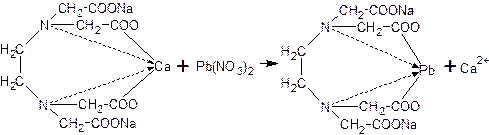
На этой же реакции основано и детоксицирующее действие препарата при отравлении свинцом, кобальтом, кадмием, иттрием, церием и др. При отравлении солями бария и стронция тетацин-кальций не применяют, так как комплекс их с ЭДТА еще более не устойчив, чем с кальцием.
Если теперь добавить к этому раствору раствор оксалата аммония, то образуется белый осадок оксалата кальция (а не муть).
Дата добавления: 2017-05-18; просмотров: 1052;
