Термодинамические процессы идеальных газов
Процесс перехода системы из одного равновесного состояния в другое равновесное состояние называют термодинамическим процессом. Все возможные термодинамические процессы изменения состояния идеального газа могут быть описаны одним уравнением (при условии, теплоемкость при их протекании постоянна):
Pυn = const (1.18)
Такой обобщенный процесс называют политропным, «n» - показатель политропы – любое число от - ∞ до + ∞, сохраняющее постоянное значение для каждого конкретного процесса.
Частными случаями политропного являются изохорный (протекающий при постоянном объеме), изобарный (при постоянном давлении), изотермический (при постоянной температуре), и адиабатный (протекающий без теплообмена с окружающей средой) процессы.
Основные зависимости для расчета термодинамических процессов идеальных газов приводятся в таблице 4.
Если известны параметры начального и конечного состояния газа, показатель политропы можно определить по уравнениям
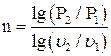 (1.19)
(1.19)
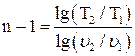 (1.20)
(1.20)
 (1.21)
(1.21)
Изменение энтропии идеального газа при протекании произвольного термодинамического процесса можно вычислить по формулам
Если известны параметры начального и конечного состояний:
ΔS = Cυ ln(T2 / T1) + Rln(υ2 / υ1) (1.22)
ΔS = Cp ln(T2 / T1) - Rln(P2 / P1) (1.23)
ΔS = Cυ ln(P2 / P1) + Срln(υ2 / υ1). (1.24)
Чтобы проследить за расположением политропных процессов при различных значениях n в Pυ и TS-диаграммах состояния идеального газа, изобразим в этих диаграммах кривые частных процессов: изохорного, изобарного, изотермического и адиабатного. По этим кривым (рис.1) можно определить относительное расположение политропы при любых других значениях n, а также определить знак у теплоты и у изменения внутренней энергии 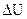 (знак
(знак 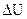 совпадает со знаком у перепада температур ΔT = T2 – T1).
совпадает со знаком у перепада температур ΔT = T2 – T1).
Из рисунка 1 видно, что все термодинамические процессы, расположенные справа от адиабаты (n = k), протекает с подводом теплоты
(q > 0), а процессы, расположенные левее линии адиабатного процесса, - с отводом теплоты (q < 0). Термодинамические процессы, располагающиеся выше изотермы (n = 1), сопровождаются ростом температуры (ΔT > 0), следовательно, протекает с увеличением внутренней энергии системы.
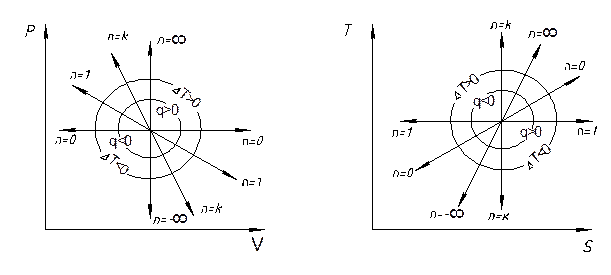
Рис.1. Изображение термодинамических процессов идеального газа в Pυ и TS диаграммах состояния.
Начальное состояние для всех процессов характеризует точка 1.
Соответственно при протекании процессов, расположенных на диаграммах ниже изотермического, температура уменьшается (ΔT < 0) и внутренняя энергия системы убывает. Для процессов с 1 < n < k характерно несовпадение знаков у теплоты q и приращения температуры ΔT. Это значит, что в указанных процессах теплоемкость газа Cx = dq / dT отрицательна.
Термодинамические процессы, расположенные правее изохоры n = ∞ протекают с увеличением объема системы (расширение), а расположенные левее – с уменьшением объема (сжатие).
Газовый цикл
Совокупность термодинамических процессов, возвращающих систему в начальное состояние, называют круговым процессом или циклом. На рис. 2 показан цикл теплового двигателя. В процессе 1а2 к рабочему телу подводится теплота q1 и она, расширяясь, совершает работу l1. В процессе 2в1 от рабочего тела отводится теплота q2, при этом затрачивается работа l2. Полезная работа за цикл равна разности работ l1 и l2 . Эту работу также можно вычислить как разность подведенной и отведенной теплот:
Lu = l1 – l2
Эффективность цикла определяется его термическим КПД. Это отношение полезной работы к количеству подведенной теплоты.
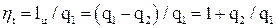 .
.

Рис. 2. Цикл теплового двигателя (прямой цикл).
Таблица 3
Дата добавления: 2017-04-20; просмотров: 1262;
