Или в более корректной форме
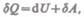 (51.2)
(51.2)
где  — бесконечно малое изменение внутренней энергии системы,
— бесконечно малое изменение внутренней энергии системы, 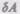 — элементарная работа,
— элементарная работа, 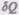 — бесконечно малое количество теплоты. В этом выражении
— бесконечно малое количество теплоты. В этом выражении  является полным дифференциалом, а
является полным дифференциалом, а 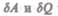 таковыми не являются. В дальнейшем
таковыми не являются. В дальнейшем
Будем использовать запись первого начала термодинамики в форме (51.2).
Из формулы (51.1) следует, что в СИ количество теплоты выражается в тех же единицах, что работа и энергия, т. е. в джоулях (Дж).
Если система периодически возвращается в первоначальное состояние, то изменение ее внутренней энергии 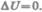 Тогда, согласно первому началу термодинамики,
Тогда, согласно первому началу термодинамики,
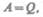
Т. е. вечный двигатель первого родя — периодически действующий двигатель, который совершал бы большую работу, чем сообщенная ему извне энергия, — невозможен (одна из формулировок первого начала термодинамики).
§ 52. Работа газапри изменении его объема
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 78). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние dl, то производит над ним работу
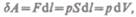
где S — площадь поршня, 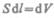 — изменение объема системы. Таким образом,
— изменение объема системы. Таким образом,
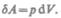 (52.1)
(52.1)
Полную работу А, совершаемую газом при изменении его объема от 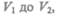 найдем
найдем
интегрированием формулы (52.1):
(52.2)
Результат интегрирования определяется 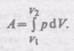 характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
характером зависимости между давлением и объемом газа. Найденное для работы выражение (52.2) справедливо при любых изменениях объема твердых, жидких и газообразных тел.
Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Пусть изменение давления газа при его расширении изображается гривой на рис. 79. При увеличении объема на dV совершаемая газом работа равна pdV, т. е. определяется площадью полоски с основанием dV, заштрихованной на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V\ до объема V2, определяется площадью, ограниченной осью абсцисс, кривой 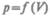 и прямыми V1 и V2.
и прямыми V1 и V2.
Графически можно изображать только равновесные процесы — процессы, состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за конечный промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными.
Теплоемкость
Удельная теплоемкость вещества — величина, равная количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
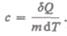
Единица удельной теплоемкости — джоуль на килограмм-кельвин (Дж/(кг * К)).
Молярная теплоемкость — величина, равная количеству теплоты, необходимому для нагревания 1 моль вещества на 1 К:
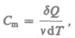 (53.1)
(53.1)
где 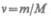 — количество вещества.
— количество вещества.
Единица молярной теплоемкости — джоуль на моль-кельвнн (Дж/(мо ль . К)). Удельная теплоемкость с связана с молярной  соотношением
соотношением
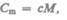 (532)
(532)
где М — молярная масса вещества.
Дата добавления: 2017-04-20; просмотров: 483;
