Некоторые особенности процесса хромирования
Электрохимические осадки хрома можно получать из растворов как трех-, так и шестивалентных соединений хрома. В промышленности применяют пока только шестивалентные соединения хрома – раствор хромовых кислот, в которых металл находится в виде анионов 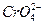 ,
, 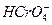 и
и 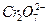 . Основой электролитов хромирования является хромовая кислота с добавкой активирующих ионов, большей частью
. Основой электролитов хромирования является хромовая кислота с добавкой активирующих ионов, большей частью 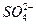 .
.
Электроосаждение хрома из раствора хромовой кислоты является одним из наиболее сложных процессов в гальваностегии. Он имеет ряд отличительных особенностей по сравнению с выделением многих других металлов: высокий отрицательный потенциал восстановления хромат-ионов, низкий выход по току (15 – 30 % в зависимости от t и ik), высокие плотности тока, обязательное присутствие в растворе некоторых посторонних анионов, необходимость применения нерастворимых анодов, очень низкая (отрицательная) рассеивающая способность электролита.
С повышением концентрации основного компонента электролита – хромовой кислоты – выход по току заметно снижается; в других гальванических процессах выход по току в большей или меньшей степени повышается по мере увеличения концентрации соли осаждающегося металла. С повышением температуры хромового электролита выход по току резко понижается, в большинстве других процессов выход по току повышается по мере повышения температуры. С повышением плотности тока выход по току значительно повышается.
Все эти особенности связаны с составом применяемого электролита и с процессами, протекающими на электродах при прохождении через систему электрического тока.
При электролизе в электролитах хромирования на катоде одновременно идут реакции восстановления шестивалентных ионов хрома до низшей валентности, выделение осадка металла, разряд ионов водорода. Хотя механизм восстановления ионов хрома является предметом многих исследований, чрезвычайная сложность явлений, сопровождающих процесс хромирования, не позволяет пока считать решение этого вопроса окончательным.
Большинство исследователей связывает восстановление хромовой кислоты с образованием на катоде фазовой пассивирующей пленки, при наличии которой потенциал значительно смещается в сторону отрицательных значений, достигая потенциала восстановления ионов хрома до металла. При этом большое влияние оказывает присутствие в растворе посторонних анионов.
Получение качественных осадков хрома возможно лишь при наличии в электролите активирующих ионов 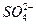 , F-,
, F-, 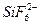 , которые служат активаторами процесса. Выделения хрома без добавок не происходит из-за пассивации катода, на котором выделяется только водород.
, которые служат активаторами процесса. Выделения хрома без добавок не происходит из-за пассивации катода, на котором выделяется только водород.
В зависимости от потенциала меняется как характер, так и скорость электрохимических реакций. Последнее иллюстрируется поляризационными кривыми, полученными потенциостатическим методом в растворе хромовой кислоты (250 г/л CrО3) без добавок и с добавкой 2,5 г/л H2SO4 при 18°С (рис. 11.1).
Характер и скорость процесса в электролитах без добавок и с добавками посторонних анионов резко отличаются. В отсутствие добавок уже при низкой плотности тока потенциал катода значительно смещается в сторону отрицательных значений (рис. 11.1, кр. 1) и при достижении – (0,86 – 0,90) В выделяется лишь один водород на металле, покрытом пассивирующей пленкой оксидной природы. В присутствии постороннего аниона, играющего роль активатора (рис.11.1, кр. 2) скорость процесса вначале возрастает (участок а – б), что говорит о депассивирующем действии добавки и активном состоянии поверхности. На этом участке идет неполное восстановление Cr6+ до Cr+3 по уравнению:
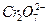 + 14H+ + 6
+ 14H+ + 6  → 2Cr3+ + 7H2O (11.a)
→ 2Cr3+ + 7H2O (11.a)
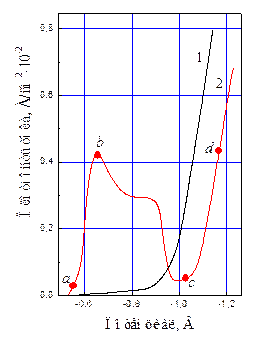
Рис. 11.1 Зависимость плотности тока от потенциала при электролизе 2,5 моль/л раствора хромовой кислоты без добавок (1) и с добавкой 0,025 моль/л H2SO4 (2) на хромовом катоде при 18°С (потенциостатический метод)
Значение предельного тока до перегиба поляризационной кривой (б) повышается с увеличением концентрации ионов 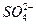 . Следующий участок кривой (б – с), показывающий падение тока при росте потенциала, говорит о том, что наряду с протеканием первой реакции на катоде образуется фазовая пассивирующая пленка, включающая хроматы и пассивирующие ионы. При потенциала -1,1 В на участке b – с, наряду с реакцией (11.a), скорость которой постепенно снижается, происходит выделение водорода
. Следующий участок кривой (б – с), показывающий падение тока при росте потенциала, говорит о том, что наряду с протеканием первой реакции на катоде образуется фазовая пассивирующая пленка, включающая хроматы и пассивирующие ионы. При потенциала -1,1 В на участке b – с, наряду с реакцией (11.a), скорость которой постепенно снижается, происходит выделение водорода
2H3O+ + 2  → H2 + 2H2O (11.б)
→ H2 + 2H2O (11.б)
На этом участке в присутствии посторонних анионов возможно также химическое восстановление хромат-ионов атомарным водородом до Cr3+. По данным М.А.Шлугера, катодная пленка содержит 66 – 67% Cr6+, 22 – 23% Cr3+, 10 – 12% 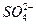 - толщина ее около 0,1 мкм и может несколько увеличиваться с повышением концентрации в электролите ионов-активаторов.
- толщина ее около 0,1 мкм и может несколько увеличиваться с повышением концентрации в электролите ионов-активаторов.
Формирование этой пленки сопровождается ростом поляризационного сопротивления электрода, следствием чего является сдвиг катодного потенциала до значений, при которых возможно выделение хрома. Фазовая пленка, затрудняя более выгодные в энергетическом отношении реакции (11.а), (11.б) создает благоприятные условия протекания реакции восстановления Cr6+ до Cr0.
При режиме второго подъема поляризационной кривой (c – d) имеют место три одновременно протекающие реакции: восстановление Cr6+ до Cr3+, выделение металла и восстановление Cr6+ до Cr0.
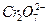 + 14H+ + 12
+ 14H+ + 12  → 2Cr + 7H2O (11.в)
→ 2Cr + 7H2O (11.в)
Рассматривая роль в этих процессах ионов-активаторов полагают, что они ограничивают образование на металле пленки оксидной природы, которая понижает его реакционную способность, и открывают таким путем возможность протекания реакции при более отрицательном значении потенциала, характерным для выделения осадка хрома. Предполагается также, что в присутствии 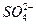 могут образовываться сульфатно-хроматные комплексы, более склонные к катодному восстановлению, чем хромовая кислота в отсутствие добавки.
могут образовываться сульфатно-хроматные комплексы, более склонные к катодному восстановлению, чем хромовая кислота в отсутствие добавки.
Отмечается, что сульфат-ионы и другие посторонние анионы могут рассматриваться как катализаторы, которые могут образовывать с хромат-ионами и положительным золем гидроокиси хрома промежуточные химические соединения, восстановление которых на катоде облегчается из-за их адсорбированного состояния (катодная пленка).
Дата добавления: 2017-01-29; просмотров: 1488;
