Электролиты и режимы электролиза.
Основным компонентом хромового электролита является хромовый ангидрид, анионы 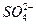 , F-,
, F-, 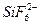 . Концентрацию хромовой кислоты можно изменять в широких пределах от 50 до 500 г/л и даже 600 г/л, поддерживая постоянным соотношение CrO3: H2SO4 = 100:1. При большем относительном содержании сульфат-иона заметно уменьшается рассеивающая способность электролита хромирования. Эта величина может несколько изменяться в зависимости от природы введенных активирующих добавок и режима электролиза. Значительные отклонения от оптимального значения сопровождаются падением выхода металла по току и увеличением доли тока, затрачиваемого на реакции выделения водорода и восстановления Cr3+ до ионов меньшей валентности. С повышением концентрации хромовой кислоты в растворе, содержащем сульфат-ионы, выход по току хрома снижается; в присутствии фтористоводородной и кремнефтористоводородной кислот он достигает максимума при более высоких концентрациях CrO3, затем снова снижается. На рис. 11.2 показана зависимость выходов металлического хрома по току от концентрации CrO3 при 55°С и плотности тока 50·102 А/м2 (0,5·102 А/см2) в растворе, содержащем добавки трех различных кислот. Несмотря на более высокий выход по току в присутствии F- и
. Концентрацию хромовой кислоты можно изменять в широких пределах от 50 до 500 г/л и даже 600 г/л, поддерживая постоянным соотношение CrO3: H2SO4 = 100:1. При большем относительном содержании сульфат-иона заметно уменьшается рассеивающая способность электролита хромирования. Эта величина может несколько изменяться в зависимости от природы введенных активирующих добавок и режима электролиза. Значительные отклонения от оптимального значения сопровождаются падением выхода металла по току и увеличением доли тока, затрачиваемого на реакции выделения водорода и восстановления Cr3+ до ионов меньшей валентности. С повышением концентрации хромовой кислоты в растворе, содержащем сульфат-ионы, выход по току хрома снижается; в присутствии фтористоводородной и кремнефтористоводородной кислот он достигает максимума при более высоких концентрациях CrO3, затем снова снижается. На рис. 11.2 показана зависимость выходов металлического хрома по току от концентрации CrO3 при 55°С и плотности тока 50·102 А/м2 (0,5·102 А/см2) в растворе, содержащем добавки трех различных кислот. Несмотря на более высокий выход по току в присутствии F- и 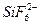 , электролиты с добавками сульфат-ионов имеют большее распространение. Недостатками электролитов с добавками фторсодержащих соединений являются повышенная чувствительность к колебаниям содержания основных компонентов, к загрязнениям, агрессивность по отношению к стеклу и керамическим изделиям, увеличение износа анодов. Поэтому чаще всего применяют сульфат- содержащие электролиты. Сульфат вводится в виде серной кислоты.
, электролиты с добавками сульфат-ионов имеют большее распространение. Недостатками электролитов с добавками фторсодержащих соединений являются повышенная чувствительность к колебаниям содержания основных компонентов, к загрязнениям, агрессивность по отношению к стеклу и керамическим изделиям, увеличение износа анодов. Поэтому чаще всего применяют сульфат- содержащие электролиты. Сульфат вводится в виде серной кислоты.
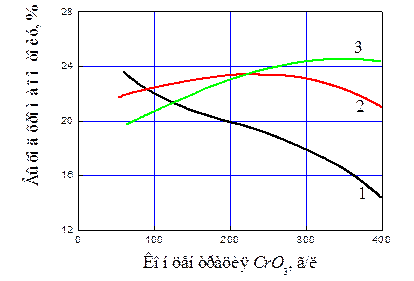
Рис. 11.2 Зависимость выхода по току хрома от концентрации хромовой кислоты в присутствии различных агентов: 1 – 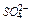 ; 2 – F-; 3 –
; 2 – F-; 3 – 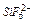
Кроме хромовой кислоты и серной кислоты в электролите должны содержаться соединения трехвалентного хрома. Трехвалентный хром образуется в результате неполного восстановления шестивалентного хрома, для чего электролит предварительно прорабатывают постоянным током при низкой катодной и высокой анодной плотности. В присутствии небольшого количества Cr3+ несколько улучшается рассеивающая способность электролита, но избыток его ухудшает качество хромовых покрытий. Допустимое содержание Cr3+ составляет 1 – 2%.
Промышленные электролиты подразделяются на три группы, различающиеся по концентрации хромата: разбавленные (100 – 170 г/л CrO3), средние или универсальные (200 – 250 г/л CrO3) и концентрированные (340 – 350 г/л CrO3).
Разбавленные электролиты характеризуются наибольшей рассеивающей способностью и выходом металла по току (16 – 18%), высокой твердостью получаемых покрытий. Наряду с этим, их стойкость против коррозии относительно невысока, а степень наводораживания металла выше, чем в универсальном.
В универсальном электролите в широком диапазоне режимов электролиза можно получить как блестящие, так и твердые износостойкие покрытия. Это обстоятельство определило его широкое разностороннее применение. Выход металла по току составляет 12 – 15%.
Концентрированные растворы более устойчивы по составу в процессе эксплуатации. Они отличаются малым выходом по току (8 – 10%), низкой рассеивающей способностью, невысокой твердостью получаемых покрытий. Их можно использовать для декоративного хромирования деталей сложной конфигурации. Однако широкого применения в производстве они не нашли как из-за указанных выше недостатков, так и из-за больших потерь хроматов при промывке хромированных деталей и затрат на обезвреживание промышленных стоков.
Усовершенствование электролитов хромирования с целью улучшения их эксплуатационных характеристик и свойств покрытий связано с введением в раствор активирующих ионов (фторидов, кремнефторидов) или легирующих металлов (кадмия, стронция, молибдена). Для поддержания требуемой концентрации в электролите ионов 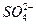 вводят сульфат стронция. Эта труднорастворимая соль, частично оставаясь на дне ванны, играет роль донора сульфат-ионов, постепенно отдавая их в раствор.
вводят сульфат стронция. Эта труднорастворимая соль, частично оставаясь на дне ванны, играет роль донора сульфат-ионов, постепенно отдавая их в раствор.
Практическое применение получил раствор хромового ангидрида (250 – 300 г/л) с добавками H2SO4 и 20 г/л K2SiF6 при 50 – 70°С и ik = (40 - 70)·102 А/дм2 (0,4 – 0,7 А/см2). Сернокислый стронций и кремнефтористоводородный калий имеют ограниченную растворимость в хромовой кислоте. Поэтому при наличии этих солей в избытке (в виде ионов твердой фазы) нужная концентрация анионов 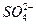 в электролите сохраняется более постоянной в процессе работы ванны и в случае ее снижения со временем восстанавливается автоматически. Такой электролит называется саморегулирующимся. В этом электролите выход хрома по току мало зависит от изменения плотности тока и температуры, что позволяет его применять для хромирования с получением деталей определенных размеров – так называемое размерное хромирование. Для получения твердых износостойких осадков используют электролит, содержащий (г/л): 250 – 350 CrO3, 18 – 20 K2SiF6, 5,5 - 6,5 SrSO4 при t = 55 – 65°С и i = 50 – 100 А/дм2 (0,5 – 1 А/см2).
в электролите сохраняется более постоянной в процессе работы ванны и в случае ее снижения со временем восстанавливается автоматически. Такой электролит называется саморегулирующимся. В этом электролите выход хрома по току мало зависит от изменения плотности тока и температуры, что позволяет его применять для хромирования с получением деталей определенных размеров – так называемое размерное хромирование. Для получения твердых износостойких осадков используют электролит, содержащий (г/л): 250 – 350 CrO3, 18 – 20 K2SiF6, 5,5 - 6,5 SrSO4 при t = 55 – 65°С и i = 50 – 100 А/дм2 (0,5 – 1 А/см2).
Одним из наименее агрессивных, работающих при комнатной температуре, является тетрахроматный электролит, в котором часть хромовой кислоты нейтрализована гидроксидом натрия. Предполагается, что при этом образуется тетрахромат натрия.
Существенным преимуществом тетрахроматного электролита являются: возможность вести электролиз при 18 – 25°С, сравнительно высокие выходы по току – 30 – 40% и рассеивающая способность около 30%. Покрытия формируются малопористые, что указывает на их хорошие защитные свойства. Тетрахроматный электролит целесообразно использовать для хромирования деталей сложной конфигурации и получения антикоррозионных покрытий.
Тетрахроматный электролит имеет следующий состав (г/л): 350 – 400 CrO3, 50 – 60 NaOH, 2,5 - 2,7 H2SO4, 10 - 15 Cr3+ (в пересчете на Cr2O3). Электролиз ведут при t = 18°С, ik = 10 – 70 А/дм2 (0,1 – 0,7 А/см2).
Дата добавления: 2017-01-29; просмотров: 1337;
