Условия культивирования и этапы микроразмножения
После тщательного перемешивания компонентов питательной среды регулируется рН всей смеси путем добавления 0,1 N NaOH и 0,1 N НС1. Для среды Мурасиге — Скуга рН устанавливается на уровне 5,7-5,8, у среды для культивирования древесных растений (WPM) оптимальная рН=5,2.
Факторы окружающей среды, такие как свет, температура и состав воздуха, могут влиять на рост и развитие клеток в культуре органов и тканей. Действие этих факторов взаимосвязано. Обычно микроклональное размножение древесных растений проводят при нормальной комнатной температуре и при сохранении того фотопериода, который наблюдается в это время в природе. Чтобы установить оптимальные параметры внешней среды, для многих видов древесных растений необходимо провести дополнительные исследования.
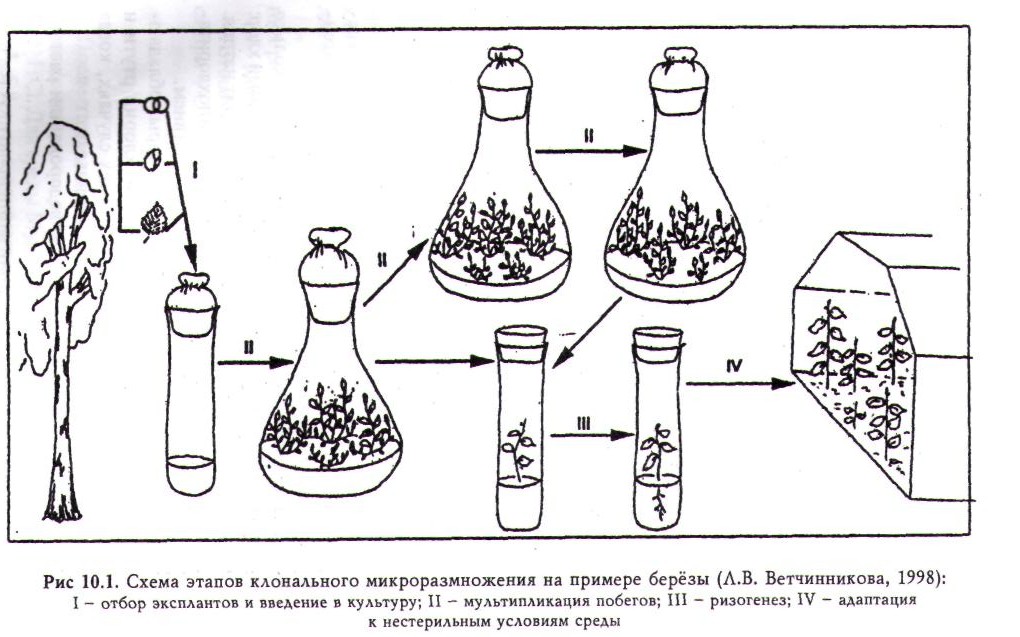
Процесс микроразмножения растений состоит из нескольких этапов. Большинство исследователей выделяют три этапа: эксплантирование исходного материала, собственно микроразмножение, укоренение размноженных побегов. При получении посадочного материала древесных растений методом микроклонирования целесообразно выделить и четвертый этап — адаптации регенерантов к нестерильным условиям среды (рис. 10.1). ,
Отбор эксплантов и введение их в культуру. Для микроразмножения древесных растений используют два основных типа исходного материала: 1) ювенильный (семена и их отдельные части, а также части проростков); 2) молодые ткани взрослых растений (почки, хвоя, ткани листа, побеги). Чаще в качестве экспланта служит ювенильный материал.
Перед введением в культуру материал стерилизуют. Установлено, что из всех видов растений древесные породы — самый трудный и сложный объект для получения культуры тканей, так как все типы исходного материала у них сильно заражены (Г.П. Бутова, 1989). Стерилизацию проводят очень осторожно, чтобы не повредить нежные ткани экспланта; концентрация стерилизующих агентов подбирается на возможно более низком уровне.
Стерилизующие растворы могут быть разделены на несколько групп. Первая из них включает растворы, содержащие активный хлор: хлорамин, хлорная известь, гипохлорит кальция и гипохлорит натрия. Хлорамин используется чаще. Этот препарат наряду с гипохлоритами обладает наименее выраженным токсическим действием.
Вторая группа включает ртутьсодержащие растворы, обладающие наибольшим дезинфицирующим эффектом: хлорид ртути и диацид. Растворы второй группы используют в тех случаях, когда препараты первой группы оказались неэффективными.
Иногда материал стерилизуют перекисью водорода или раствором иода.
Для повышения эффективности стерилизации практикуется последовательное применение стерилизующего агента с 70%-ным эти ловым спиртом. Эксплант опускают на 1-3 % в спирт, а затем переносят в стерилизующий раствор. Перед высадкой на питательную среду материал ополаскивают в стерильной воде.
Мультипликация побегов. При правильно подобранной питательной среде, надежной стерилизации и подходящих условиях культивирования в пробирке или колбе образуется несколько побегов. Часть из них пересаживают на новую среду для образования корней, а другую повторно культивируют для увеличения количества побегов. Этот процесс повторяют многократно до получения требуемого количества посадочного материала.
Ризогенез. Питательная среда для культивирования побегов с целью образования на них корней обычно несколько отличается от среды, которая использовалась на первом этапе. Установлено, что для многих растений необходимо использовать среду с низким содержанием солей. Так, в среде Мурасиге — Скуга концентрация солей уменьшается в два или даже в четыре раза. Некоторые травянистые растения не нуждаются в добавлении в среду регуляторов роста, но чаще требуются ауксины. Время, необходимое для формирование корней, варьирует от 10 до 15 дней. Растения из пробирки пересаживают, когда корни достигнут 5 мм длины. Более длинные корни могут при пересадке поломаться.
Адаптация к нестерильным условиям среды. Для переноса растений из культуральных сосудов в почву требуется особая осторожность. Корни промываются для удаления налипшей на них питательной среды. Первые 10-15 дней в теплице поддерживается высокая влажность (90-100%). Для древесных растений в этих целях используют установки искусственного тумана. Также необходимо защищать растения от прямого солнечного света.
***
Клональное микроразмножение — принципиально новый способ получения клонов у древесных растений. Одним из важных преимуществ этого способа является то, что удается тиражировать растения, которые с трудом или совсем не размножаются вегетативно, черенками или прививкой. Массовое использование клонального микроразмножения позволяет перевести искусственное лесовосста-новление на более высокий уровень, улучшить культуру лесохозяйственного производства. Так же как совершенствование приемов и методов лесного семеноведения определяет прогресс в других областях лесной науки, клональное микроразмножение способствует внедрению в лесное хозяйство достижений лесной селекции, семеноводства и сортовыведения.
Универсальной технологии клонального микроразмножения нет; питательные среды и условия культивирования подбираются для каждого вида, а часто и для индивидуального древесного растения опытным путем, защищены свидетельствами на изобретение и патентами. Вопрос о приобретении патента в каждом конкретном случае должен решаться специалистами с учетом технологических возможностей предприятия, ценности вида или сорта, экономической целесообразности.

Вопросы для самопроверки
1. Что такое клональное микроразмножение?
2. Что необходимо для правильной организации работ по микроразмножению?
3. Какие основные вещества входят в состав питательных сред и их действие?
4. Опишите условия культивирования эксплантов.
5. Назовите основные этапы микроразмножения.
Глава 11
Селекция хвойных древесных пород
Хвойные (точнее, сосновые) породы в нашей стране являются основными лесообразователями. Они занимают преобладающее положение в таежных лесах европейской и азиатской частей России. Имеется множество направлений использования их в народном хозяйстве. Главной их ценностью является древесина, но не только она. Они дают живицу, орехи (сосна сибирская), бальзам, гумми и другие ценные вещества. Отсюда и селекция этих пород направлена на повышение продуктивности и качества древесины, увеличение выхода ценных компонентов деревьев, повышение их устойчивости.
Считается, что исходным основным числом хромосом у всего порядка Coniferales является n=12 (Е.Н. Муратова, М.В. Круклис, 1988; Z. Borzan, 1991). Оно, в частности, наблюдается и у большинства видов семейства Pinaceae.
Селекционные программы хвойных должны включать направления работ, перечисленные ранее (см. гл. 1). Селекция идет на быстроту роста, продуктивность и качество древесины (практически у всех пород), на смолопродуктивность (сосна), выход бальзама (пихта), урожайность орешков (сосна сибирская), резонансность древесины (ель), устойчивость к вредным воздействиям окружающей среды (все породы) и другие признаки.
Основным методом селекции у большинства хвойных является отбор, хотя для некоторых пород в последние десятилетия активно развиваются гибридизация, мутагенез и др. Ниже приводятся некоторые особенности селекции и репродукции отдельных видов хвойных.
Дата добавления: 2017-01-13; просмотров: 1840;
