Антидиуретический гормон
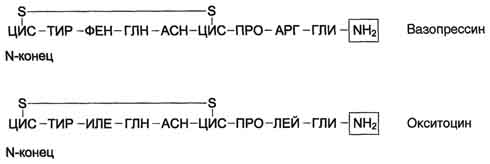
Антидиуретический гормон (АДГ), или вазопрессин - пептид с молекулярной массой около 1100 Д, содержащий 9 аминокислот, соединённых одним дисульфидным мостиком.
Синтез и секреция антидиуретического гормона. АДГ синтезируется в нейронах гипоталамуса в виде предшественника препрогормона, который поступает в аппарат Гольджи и превращается в прогормон. В составе нейросекреторных гранул прогормон переносится в нервные окончания задней доли гипофиза (нейрогипофиз). Во время транспорта гранул происходит процессинг прогормона, в результате чего он расщепляется на зрелый гормон и транспортный белок - нейрофизин. Гранулы, содержащие зрелый антидиуретический гормон и нейрофизин, хранятся в терминальных расширениях аксонов в задней доле гипофиза, из которых секретируются в кровоток при соответствующей стимуляции. Стимулом, вызывающим секрецию АДГ, служит повышение концентрации ионов натрия и увеличение осмотического давления внеклеточной жидкости. При недостаточном потреблении воды, сильном потоотделении или после приёма большого количества соли осморецепторы гипоталамуса, чувствительные к колебаниям осмолярности, регистрируют повышение осмотического давления крови. Возникают нервные импульсы, которые передаются в заднюю долю гипофиза и вызывают высвобождение АДГ. Секреция АДГ происходит также в ответ на сигналы от барорецепторов предсердий. Изменение осмолярности всего на 1% приводит к заметным изменениям секреции АДГ.
Механизм действия.Для АДГ существуют 2 типа рецепторов: V1 и V2. Рецепторы V2, опосредующие главный физиологический эффект гормона, обнаружены на базолатеральной мембране клеток собирательных трубочек и дистальных канальцев - наиболее важных клеток-мишеней для АДГ, которые относительно непроницаемы для молекул воды. В отсутствие АДГ моча не концентрируется и может выделяться в количествах, превышающих 20 л в сутки (норма 1,0-1,5 л в сутки). Связывание АДГ с V2 стимулирует аденилатциклазную систему и активацию протеинкиназы А. В свою очередь, протеинкиназа А фосфорилирует белки, стимулирующие экспрессию гена мембранного белка - аквапорина-2. Аквапорин-2 перемещается к апикальной мембране собирательных канальцев и встраивается в неё, образуя водные каналы. Это обеспечивает избирательную проницаемость мембраны клеток для воды, которые свободно диффундируют в клетки почечных канальцев и затем поступают в интерстициальное пространство. Поскольку в результате происходит реабсорбция воды из почечных канальцев и экскреция малого объёма высококонцентрированной мочи (антидиурез), гормон называют антидиуретическим гормоном.
Рецепторы типа V1 локализованы в мембранах ГМК сосудов. Взаимодействие АДГ с рецептором V1 приводит к активации фосфолипазы С, которая гидролизует фосфатидилинозитол-4,5-бисфосфат с образованием инозитолтрифосфата и диацилглицерола. Инозитолтрифосфат вызывает высвобождение Са2+ из ЭР. Результатом действия гормона через рецепторы V1 является сокращение гладкомышечного слоя сосудов. Сосудосуживающий эффект АДГ проявляется при высоких концентрациях гормона. Поскольку сродство АДГ к рецептору V2 выше, чем к рецептору V1, при физиологической концентрации гормона в основном проявляется его антидиуретическое действие.
Альдостерон
Альдостерон - наиболее активный минералокортикостероид, синтезирующийся в коре надпочечников из холестерола.
Синтез и секрецияальдостерона клетками клубочковой зоны непосредственно стимулируются низкой концентрацией Na+ и высокой концентрацией К+ в плазме крови. На секрецию альдостерона влияют также простагландины, АКТГ. Однако наиболее важное влияние на секрецию альдостерона оказывает ренинангиотензиновая система. Альдостерон не имеет специфических транспортных белков, но за счёт слабых взаимодействий может образовывать комплексы с альбумином. Гормон очень быстро захватывается печенью, где превращается в тетрагидроальдостерон-3-глюкуронид и экскретируется с мочой.
Механизм действия альдостерона. В клетках-мишенях гормон взаимодействует с рецепторами, которые могут быть локализованы как в ядре, так и в цитозоле клетки. Образовавшийся комплекс гормон-рецептор взаимодействует с определённым участком ДНК и изменяет скорость транскрипции специфических генов. Результат действия альдостерона - индукция синтеза: а) белков-транспортёров Na+ из просвета канальца в эпителиальную клетку почечного канальца; б) Nа+,К+,-АТФ-азы, обеспечивающей удаление ионов натрия из клетки почечного канальца в межклеточное пространство и переносящей ионы калия из межклеточного пространства в клетку почечного канальца; в) белков-транспортёров ионов калия из клеток почечного канальца в первичную мочу; г) митохондриальных ферментов ЦТК, в частности цитратсинтазы, стимулирующих образование молекул АТФ, необходимых для активного транспорта ионов. Суммарным биологическим эффектом индуцируемых альдостероном белков является увеличение реабсорбции ионов натрия в канальцах нефронов, что вызывает задержку NaCl в организме, и возрастание экскреции калия.
124. Система ренин-ангиотензин-альдостерон. Биохимические механизмы возникновения почечной гипертонии, отеков, дегидратации.
Главным механизмом регуляции синтеза и секреции альдостерона служит система ренин-ангиотензин.
Ренин - протеолитический фермент, продуцируемый юкстагломерулярными клетками, расположенными вдоль конечной части афферентных (приносящих) артериол, входящих в почечные клубочки. Юкстагломерулярные клетки особенно чувствительны к снижению перфузионного давления в почках. Уменьшение АД (кровотечение, потеря жидкости, снижение концентрации NaCl) сопровождается падением перфузионного давления в приносящих артериолах клубочка и соответствующей стимуляцией высвобождения ренина. Субстратом для ренина служит ангиотензиноген. Ангиотензиноген - α2-глобулин, содержащий более чем 400 аминокислотных остатков. Образование ангиотензиногена происходит в печени и стимулируется глюкокортикоидами и эстрогенами. Ренин гидролизует пептидную связь в молекуле ангиотензиногена и отщепляет N-концевой декапептид (ангиотензин I), не имеющий биологической активности. Под действием карбоксидипептидилпептидазы, или антиотензин-превращающего фермента (АПФ), выявленного в эндотелиальных клетках, лёгких и плазме крови, с С-конца ангиотензина I удаляются 2 аминокислоты и образуется октапептид - ангиотензин II. Ангиотензин II, связываясь со специфическими рецепторами, локализованными на поверхности клеток клубочковой зоны коры надпочечников и ГМК, вызывает изменение внутриклеточной концентрации диацилглицерола и инозитолтрифосфата. Инозитолтрифосфат стимулирует высвобождение из ЭР ионов кальция, совместно с которым активирует протеинкиназу С, опосредуя тем самым специфический биологический ответ клетки на действие ангиотензина II. При участии аминопептидаз ангиотензин II превращается в ангиотензин III - гептапептид, проявляющий активность ангиотензина II. Однако концентрация гептапептида в плазме крови в 4 раза меньше концентрации октапептида, и поэтому большинство эффектов являются результатом действия ангиотензина П. Дальнейшее расщепление ангиотензина II и ангиотензина III протекает при участии специфических протеаз (ангиотензиназ). Ангиотензин II оказывает стимулирующее действие на продукцию и секрецию альдостерона клетками клубочковой зоны коры надпочечников, который, в свою очередь, вызывает задержку ионов натрия и воды, в результате чего объём жидкости в организме восстанавливается. Кроме этого, ангиотензин II, присутствуя в крови в высоких концентрациях, оказывает мощное сосудосуживающее действие и тем самым повышает АД.
Гиперальдостеронизм - заболевание, вызванное гиперсекрецией альдостерона надпочечниками. Причиной первичного гиперальдостеронизма (синдром Кона) примерно у 80% больных является аденома надпочечников, в остальных случаях - диффузная гипертрофия клеток клубочковой зоны, вырабатывающих альдостерон. При первичном гиперальдостеронизме избыток альдостерона усиливает реабсорбцию натрия в почечных канальцах. Увеличение концентрации Na+ в плазме служит стимулом к секреции АДГ и задержке воды почками. Кроме того, усиливается выведение ионов калия, магния и протонов. В результате развиваются гипернатриемия, вызывающая, в частности, гипертонию, гипер-волемию и отёки, а также гипокалиемия, ведущая к мышечной слабости, возникают дефицит магния и лёгкий метаболический алкалоз.
Вторичный гиперальдостеронизмвстречается гораздо чаще, чем первичный, и может быть связан с рядом состояний (например, сердечная недостаточность, хронические заболевания почек, а также сопровождающиеся нарушением кровоснабжения опухоли, секретирующие ренин). При вторичном гиперальдостеронизме у больных наблюдают повышенный уровень ренина и ангиотензина II, что стимулирует кору надпочечников продуцировать и секретировать избыточное количество альдостерона. Клинические симптомы менее выражены, чем при первичном альдостеронизе. Одновременное определение концентрации альдостерона и активности ренина в плазме позволяет окончательно дифференцировать первичный (активность ренина в плазме снижена) и вторичный (активность ренина в плазме повышена) гиперальдостеронизм.
125. Роль гормонов в регуляции обмена кальция и фосфатов (паратгормон, кальцитонин). Причины и проявления гипо- и гиперпаратироидизма.
Основными регуляторами обмена Са2+ в крови являются паратгормон, кальцитриол и кальцитонин.
Паратгормон
Паратгормон (ПТГ) - одноцепочечный полипептид, состоящий из 84 аминокислотных остатков (около 9,5 кД), действие которого направлено на повышение концентрации ионов кальция и снижение концентрации фосфатов в плазме крови.
Синтез и секреция ПТГ.ПТГ синтезируется в паращитовидных железах в виде предшественника - препрогормона, содержащего 115 аминокислотных остатков. Во время переноса в ЭР от препрогормона отщепляется сигнальный пептид, содержащий 25 аминокислотных остатков. Образующийся прогормон транспортируется в аппарат Гольджи, где происходит превращение предшественника в зрелый гормон, включающий 84 аминокислотных остатка (ПТГ1-84). Паратгормон упаковывается и хранится в секреторных гранулах (везикулах). Интактный паратгормон может расщепляться на короткие пептиды: N-концевые, С-концевые и срединные фрагменты. N-концевые пептиды, содержащие 34 аминокислотных остатка, обладают полной биологической активностью и секретируются железами наряду со зрелым паратгормоном. Именно N-концевой пептид отвечает за связывание с рецепторами на клетках-мишенях. Роль С-концевого фрагмента точно не установлена. Скорость распада гормона уменьшается при низкой концентрации ионов кальция и увеличивается, если концентрация ионов кальция высока. Секреция ПТГрегулируется уровнем ионов кальция в плазме: гормон секретируется в ответ на снижение концентрации кальция в крови.
Роль паратгормона в регуляции обмена кальция и фосфатов.Органы-мишенидля ПТГ - кости и почки. В клетках почек и костной ткани локализованы специфические рецепторы, которые взаимодействуют с паратгормоном, в результате чего инициируется каскад событий, приводящий к активации аденилатциклазы. Внутри клетки возрастает концентрация молекул цАМФ, действие которых стимулирует мобилизацию ионов кальция из внутриклеточных запасов. Ионы кальция активируют киназы, которые фосфорилируют особые белки, индуцирующие транскрипцию специфических генов. В костной ткани рецепторы ПТГ локализованы на остеобластах и остеоцитах, но не обнаружены на остеокластах. При связывании паратгормона с рецепторами клеток-мишеней остеобласты начинают усиленно секретировать инсулиноподобный фактор роста 1 и цитокины. Эти вещества стимулируют метаболическую активность остеокластов. В частности, ускоряется образование ферментов, таких как щелочная фосфатаза и коллагеназа, которые воздействуют на компоненты костного матрикса, вызывают его распад, в результате чего происходит мобилизация Са2+ и фосфатов из кости во внеклеточную жидкость. В почках ПТГ стимулирует реабсорбцию кальция в дистальных извитых канальцах и тем самым снижает экскрецию кальция с мочой, уменьшает реабсорбцию фосфатов.Кроме того, паратгормон индуцирует синтез кальцитриола (1,25(OH)2D3), который усиливает всасывание кальция в кишечнике. Таким образом, паратгормон восстанавливает нормальный уровень ионов кальция во внеклеточной жидкости как путём прямого воздействия на кости и почки, так и действуя опосредованно (через стимуляцию синтеза кальцитриола) на слизистую оболочку кишечника, увеличивая в этом случае эффективность всасывания Са2+ в кишечнике. Снижая реабсорбцию фосфатов из почек, паратгормон способствует уменьшению концентрации фосфатов во внеклеточной жидкости.
Кальцитонин - полипептид, состоящий из 32 аминокислотных остатков с одной дисульфидной связью. Гормон секретируется парафолликулярными К-клетками щитовидной железы или С-клетками паращитовидных желёз в виде высокомолекулярного белка-предшественника. Секреция кальцитонина возрастает при увеличении концентрации Са2+ и уменьшается при понижении концентрации Са2+ в крови. Кальцитонин - антагонист паратгормона. Он ингибирует высвобождение Са2+ из кости, снижая активность остеокластов. Кроме того, кальцитонин подавляет канальцевую реабсорбцию ионов кальция в почках, тем самым стимулируя их экскрецию почками с мочой. Скорость секреции кальцитонина у женщин сильно зависит от уровня эстрогенов. При недостатке эстрогенов секреция кальцитонина снижается. Это вызывает ускорение мобилизации кальция из костной ткани, что приводит к развитию остеопороза.
Гиперпаратиреоз.При первичном гиперпаратиреозе нарушается механизм подавления секреции паратгормона в ответ на гиперкальциемию. Это заболевание встречается с частотой 1:1000. Причинами могут быть опухоль околощитовидной железы (80%) или диффузная гиперплазия желёз, в некоторых случаях рак паращитовидной железы (менее 2%). Избыточная секреция паратгормона приводит к повышению мобилизации кальция и фосфатов из костной ткани, усилению реабсорбции кальция и выведению фосфатов в почках. Вследствие этого возникает гиперкальциемия, которая может приводить к снижению нервно-мышечной возбудимости и мышечной гипотонии. У больных появляются общая и мышечная слабость, быстрая утомляемость и боли в отдельных группах мышц, увеличивается риск переломов позвоночника, бедренных костей и костей предплечья. Увеличение концентрации фосфата и ионов кальция в почечных канальцах может служить причиной образования в почках камней и приводит к гиперфосфатурии и гипофосфатемии. Вторичный гиперпаратиреозвстречается при хронической почечной недостаточности и дефиците витамина D3 и сопровождается гипокальциемией, связанной в основном с нарушением всасывания кальция в кишечнике из-за угнетения образования кальцитриола поражёнными почками. В этом случае секреция паратгормона увеличивается. Однако повышенный уровень паратгормона не может нормализовать концентрацию ионов кальция в плазме крови вследствие нарушения синтеза кальцитриола и снижения всасывания кальция в кишечнике. Наряду с гипокальциемией, нередко наблюдают гиперфостатемию. У больных развивается повреждение скелета (остеопороз) вследствие повышения мобилизации кальция из костной ткани. В некоторых случаях (при развитии аденомы или гиперплазии околощитовидных желёз) автономная гиперсекреция паратгормона компенсирует гипокальциемию и приводит к гиперкальциемии (третичный гиперпаратиреоз).
Гипопаратиреоз.Основной симптом гипопаратиреоза, обусловленный недостаточностью паращитовидных желёз, - гипокальциемия. Понижение концентрации ионов кальция в крови может вызвать неврологические, офтальмологические нарушения и нарушения ССС, а также поражения соединительной ткани. У больного гипопарати-реозом отмечают повышение нервно-мышечной проводимости, приступы тонических судорог, судороги дыхательных мышц и диафрагмы, ларингоспазм.
126. Строение, биосинтез и механизм действия кальцитриола. Причины и проявление рахита
Кальцитриол
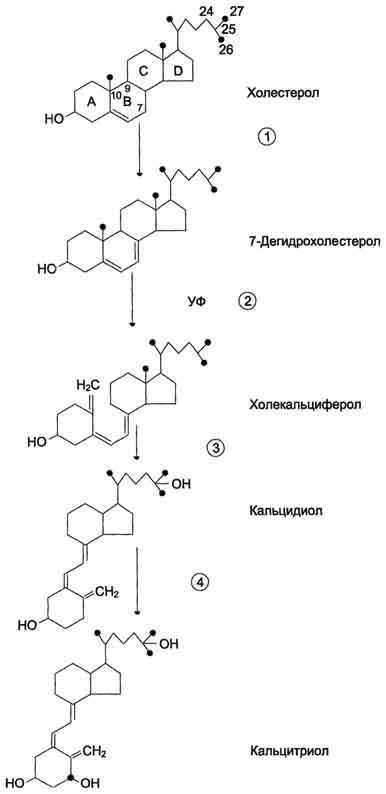
Как и другие стероидные гормоны, кальцитриол синтезируется из холестерола. Действие гормона направлено на повышение концентрации кальция в плазме крови.
Строение и синтез кальцитриола.В коже 7-дегидрохолестерол (провитамин D3) превращается в непосредственного предшественника кальцитриола - холекальциферол (витамин D3). В ходе этой неферментативной реакции под влиянием УФ-излучения связь между девятым и десятым атомами углерода в молекуле холестерола разрывается, раскрывается кольцо В, и образуется холекальциферол. Так образуется в организме человека большая часть витамина D3, однако небольшое его количество поступает с пищей и всасывается в тонком кишечнике вместе с другими жирорастворимыми витаминами. В эпидермисе холекальциферол связывается со специфическим витамин D-связывающим белком (транскальциферином), поступает в кровь и переносится в печень, где происходит гидроксилирование по 25-му атому углерода с образованием кальцидиола [25-гидроксихолекальциферол, 25(OH)D3]. В комплексе с витамин D-связывающим белком кальцидиол транспортируется в почки и гидроксилируется по первому углеродному атому с образованием кальцитриола [1,25(OH)2D3]. Именно 1,25(OH)2D3 представляет собой активную форму витамина D3. Гидроксилирование, протекающее в почках, является скорость-лимитирующей стадией. Эта реакция катализируется митохондриальным ферментом lα-гидроксилазой. Паратгормон индуцирует la-гидроксилазу, тем самым стимулируя синтез 1,25(OH)2D3. Низкая концентрация фосфатов и ионов Са2+ в крови также ускоряет синтез кальцитриола, причём ионы кальция действуют опосредованно через паратгормон. При гиперкальциемии активность 1α-гидроксилазы снижается, но повышается активность 24α-гидроксилазы. В этом случае увеличивается продукция метаболита 24,25(OH)2D3, который, возможно, и обладает биологической активностью, но роль его окончательно не выяснена.
Механизм действия кальцитриолаКальцитриол оказывает воздействие на тонкий кишечник, почки и кости. Подобно другим стероидным гормонам, кальцитриол связывается с внутриклеточным рецептором клетки-мишени. Образуется комплекс гормон-рецептор, который взаимодействует с хроматином и индуцирует транскрипцию структурных генов, в результате чего синтезируются белки, опосредующие действие кальцитриола. Так, например, в клетках кишечника кальцитриол индуцирует синтез Са2+-переносящих белков, которые обеспечивают всасывание ионов кальция и фосфатов из полости кишечника в эпителиальную клетку кишечника и далее транспорт из клетки в кровь, благодаря чему концентрация ионов кальция во внеклеточной жидкости поддерживается на уровне, необходимом для минерализации органического матрикса костной ткани. В почках кальцитриол стимулирует реабсорбцию ионов кальция и фосфатов. При недостатке кальцитриола нарушается образование аморфного фосфата кальция и кристаллов гидроксиапатитов в органическом матриксе костной ткани, что приводит к развитию рахита и остеомаляции. Обнаружено также, что при низкой концентрации ионов кальция кальцитриол способствует мобилизации кальция из костной ткани.
Рахит - заболевание детского возраста, связанное с недостаточной минерализацией костной ткани. Нарушение минерализации кости - следствие дефицита кальция. Рахит может быть обусловлен следующими причинами: недостатком витамина D3 в пищевом рационе, нарушением всасывания витамина D3 в тонком кишечнике, снижением синтеза предшественников кальцитриГола из-за недостаточного времени пребывания на солнце, дефектом 1α-гидроксилазы, дефектом рецепторов кальцитриола в клетках-мишенях. Всё это вызывает снижение всасывания кальция в кишечнике и снижение его концентрации в крови, стимуляцию секреции паратгормона и вследствие этого мобилизацию ионов кальция из кости. При рахите поражаются кости черепа; грудная клетка вместе с грудиной выступает вперёд; деформируются трубчатые кости и суставы рук и ног; увеличивается и выпячивается живот; задерживается моторное развитие. Основные способы предупреждения рахита - правильное питание и достаточная инсоляция.
127. Строение и секреция кортикостероидов. Изменения катаболизма при гипо- и гиперкортицизме.
Гормоны коры надпочечников (кортикостероиды).В коре надпочечников синтезируется более 40 различных стероидов, различающихся по структуре и биологической активности. Биологически активные кортикостероиды объединяют в 3 основные класса в зависимости от их преобладающего действия.
Глюкокортикоиды,С21-стероиды, играют важную роль в адаптации к стрессу. Они оказывают разнообразные эффекты, но наиболее важный - стимуляция глюконеогенеза. Основной глюкокортикоид человека - кор-тизол.
Минералокортикоиды,С21-стероиды, необходимы для поддержания уровня Na+ и К+. Самый активный гормон этого класса - альдостерон.
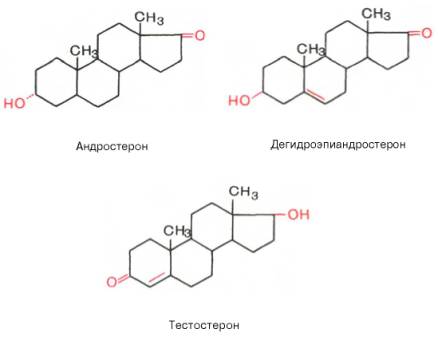
Андрогены - С19-стероиды. В коре надпочечников образуются предшественники андрогенов, из которых наиболее активный - дегидроэпиандростерон (ДЭА) и слабый - андростендион. Самый мощный андроген надпочечников тестостерон синтезируется в надпочечниках в небольшом количестве. Эти стероиды превращаются в более активные андрогены вне надпочечников. Тестостерон в незначительных количествах может превращаться в надпочечниках в эстрадиол. Но в норме продукция этих гормонов надпочечниками не играет существенной роли.
Биосинтез и метаболизм кортикостероидов. Общим предшественником кортикостероидов служит холестерол В митохондриях холестерол превращается в прегненолон при участии гидроксилазы, относящейся к группе цитохромов Р450. Цитохром Р450, отщепляющий боковую цепь, локализован во внутренней мембране митохондрий. Отщепление боковой цепи холестерола включает 2 реакции гидроксилирования: одна - по атому С22, другая - по С20. Последующее отщепление шестиуглеродного фрагмента приводит к образованию С21-стероида - прегненолона. Дальнейшее превращение прегненолона происходит под действием различных гидроксилаз с участием молекулярного кислорода и NADPH, а также дегидрогеназ, изомераз и лиаз. Эти ферменты имеют различную внутри- и межклеточную лбкализацию. В коре надпочечников различают 3 типа клеток, образующих 3 слоя, или зоны: клубочковую, пучковую и сетчатую. Каким именно стероидом окажется конечный продукт, зависит от набора ферментов в клетке и последовательности реакций гидроксилирования. Например, ферменты, необходимые для синтеза альдостерона, присутствуют только в клетках клубочковой зоны, а ферменты синтеза глюкокортикоидов и андрогенов локализованы в пучковой и сетчатой зонах.
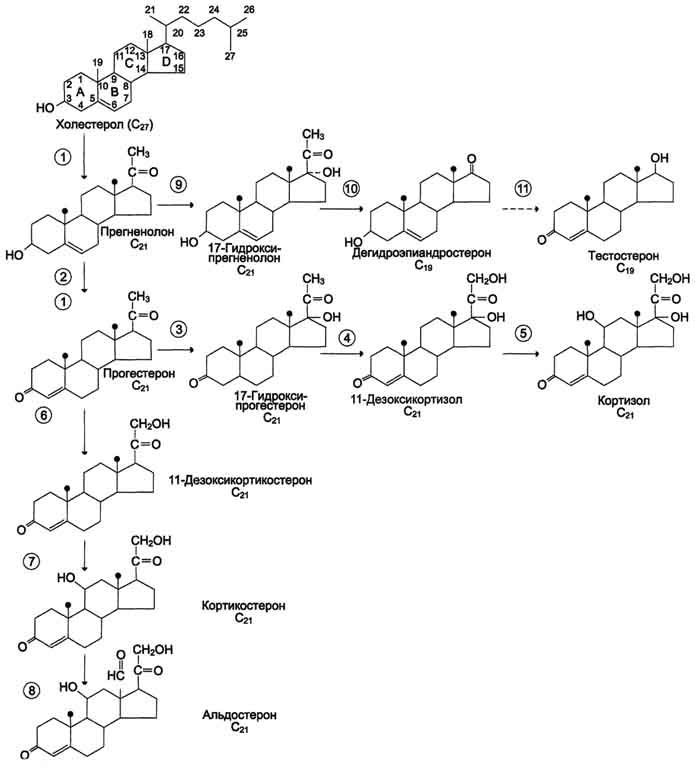
Путь биосинтеза кортизола.Кортизол синтезируется из холестерола, который в основном поступает из крови в составе ЛПНП или синтезируется в клетках из ацетил-КоА. Значительная часть эфиров холестерола накапливается в цитозоле клеток в липидных каплях. Под влиянием АКТГ происходит активация специфической эстеразы, и свободный холестерол транспортируется в митохондрии.
Синтез кортизола начинается с превращения прегненолона в прогестерон. Эта реакция протекает в цитозоле клеток пучковой зоны коры надпочечников, куда прегненолон транспортируется из митохондрий. Реакцию катализирует 3-β-гидроксистероиддегидрогеназа. В мембранах ЭР при участии 17-α-гидроксилазы происходит гидроксилирование прогестерона по С17 с образованием 17-гидроксипрогестерона. Этот же фермент катализирует превращение прегненолона в 17-гидроксипрегненолон, от которого далее при участии 17,20-лиазы может отщепляться двухуглеродная боковая цепь с образованием С19-стероида - дегидроэпиандростерона. 17 -гидроксипрогестерон служит предшественником кортизола, а дегидроэпиандростерон - предшественником андрогенов. Далее 17-ОН-прогестерон гидроксилируется 21-гидроксилазой (P450-C21), локализованной в мембране ЭР, и превращается в 11-дезоксикортизол, который переносится во внутреннюю мембрану митохондрий, где гидроксилируется при участии цитохрома Р450-с11 с образованием кортизола. Скорость синтеза и секреции кортизола стимулируются в ответ на стресс, травму, инфекцию, понижение концентрации глюкозы в крови. Повышение концентрации кортизола подавляет синтез кортиколиберина и АКТГ по механизму отрицательной обратной связи.
Синтезминералокортикоидовв клетках клубочковой зоны коры надпочечников также начинается с превращения холестерола в прегненолон, а затем в прогестерон. Прогестерон гидроксилируется вначале по С21 с образованием 11-дезоксикортикостерона. Следующее гидроксилирование происходит по С11, что приводит к образованию кортикостерона, обладающего слабовыраженной глюкокортикоидной и минералокортикоидной активностью. В клетках клубочковой зоны 17-α-гидроксилаза отсутствует, но есть митохондриальная 18-гидроксилаза, при участии которой кортикостерон гидроксилируется, а затем дегидрируется с образованием альдегидной группы у С18. Главным стимулом для синтеза альдостерона служит ангиотензин II
Транспорт кортикостеровдов.Кортизол в плазме крови находится в комплексе с α-глобулином транскортином и в небольшом количестве в свободной форме. Синтез транскортина протекает в печени и стимулируется эстрогенами. Т1/2 кортизола составляет 1,5-2 ч. Несвязанный, или свободный кортизол, составляет около 8% от общего количества гормона в плазме и является биологически активной фракцией. Альдостерон не имеет специфического транспортного белка, но образует слабые связи с альбумином.
Катаболизм гормонов коры надпочечниковпроисходит прежде всего в печени. Здесь протекают реакции гидроксилирования, окисления и восстановления гормонов. Продукты катаболизма кортикостеровдов (кроме кортикостерона и альдостерона) выводятся с мочой в форме 17-кетостероидов, образующихся в результате отщепления боковой цепи. Эти продукты метаболизма выделяются преимущественно в виде конъюгатов с глюкуроновой и серной кислотами. 17-Окси- и 17-кетостероиды образуются также при катаболизме половых гормонов, которые имеют у С17гидрокси- или кетогруппы. У мужчин 2/3 кетостероидов образуется за счёт кортикостеровдов и 1/3 за счёт тестостерона (всего 12-17 мг/суг). У женщин 17-кетостероиды образуются преимущественно за счёт кор-тикостероидов (7-12 мг/сут). Определение 17-кетостероидов в моче позволяет оценить как количество глюкокортикоидов, секретируемых корой надпочечников, так и функцию надпочечников.
Биологические функции кортикостероидовотличаются широким спектром влияний на процессы метаболизма и подробно рассматриваются в соответствующих разделах. Важнейший фактор в механизме действия кортикостеровдов - взаимодействие их со специфическими рецепторами, расположенными в цитозоле клетки или в ядре. Регуляция внутриклеточных процессов под влиянием кортико-стероидных гормонов проявляется в изменении количества белков, обычно ключевых ферментов метаболизма, путём регуляции транскрипции генов в клетках-мишенях.
Влияние глюкокортикоидов на промежуточный метаболизм связано с их способностью координированно воздействовать на разные ткани и разные процессы, как анаболические, так и катаболические. Кортизол стимулирует образование глюкозы в печени, усиливая глюконеогенез и одновременно увеличивая скорость освобождения аминокислот - субстратов глюконеогенеза из периферических тканей. В печени кортизол индуцирует синтез ферментов катаболизма аминокислот (аланинаминотрансферазы, трипто-фанпирролазы и тирозинаминотрансферазы и ключевого фермента глюконеогенеза - фосфо-енолпируваткарбоксикиназы). Кроме того, кортизол стимулирует синтез гликогена в печени и тормозит потребление глюкозы периферическими тканями. Это действие кортизола проявляется в основном при голодании и недостаточности инсулина. У здоровых людей эти эффекты кортизола уравновешиваются инсулином. Избыточное количество кортизола стимулирует липолиз в конечностях и липогенез в других частях тела (лицо и туловище). Кроме того, глюкокортикоиды усиливают липолитическое действие катехоламинов и гормона роста. Влияние глюкокортикоидов на обмен белков и нуклеиновых кислот проявляется двояко: в печени кортизол в основном оказывает анаболический эффект (стимулирует синтез белков и нуклеиновых кислот). В мышцах, лимфоидной и жировой ткани, коже и костях кортизол тормозит синтез белков, РНК и ДНК и стимулирует распад РНК и белков. При высокой концентрации глюкокортикоиды подавляют иммунные реакции, вызывая гибель лимфоцитов и инволюцию лимфоидной ткани; подавляют воспалительную реакцию, снижая число циркулирующих лейкоцитов, а также индуцируя синтез липокортинов, которые ингибируют фосфолипазу А2, снижая таким образом синтез медиаторов воспаления - простагландинов и лейкотриенов. Высокая концентрация глюкокортикоидов вызывает торможение роста и деления фибро-бластов, а также синтез коллагена и фибронектина. Для гиперсекреции глюкокортикоидов типичны истончение кожи, плохое заживление ран, мышечная слабость и атрофия мышц. Глюкокортикоиды участвуют в физиологическом ответе на стресс, связанный с травмой, инфекцией или хирургическим вмешательством. В этом ответе в первую очередь участвуют катехоламины, но во многих случаях для проявления их максимальной активности необходимо участие глюкокортикоидов.
Минералокортикоидыстимулируют реабсорбцию Na+ в дистальных извитых канальцах и собирательных трубочках почек. Кроме того, они способствуют секреции К+, NH4+ в почках, а также в других эпителиальных тканях: потовых железах, слизистой оболочке кишечника и слюнных железах. В организме человека альдостерон - наиболее активный минералокортикоид.
Изменения метаболизма при гипо- и гиперфункции коры надпочечников.Заболевания коры надпочечников могут проявиться симптомами как гипо-, так и гиперпродукции гормонов. Большинство клинических проявлений надпочечниковой недостаточности обусловлено дефицитом глюкокортикоидов и минералокортикоидов.
Острая надпочечниковая недостаточность представляет большую угрозу для жизни, так как сопровождается декомпенсацией всех видов обмена и процессов адаптации. Она проявляется сосудистым коллапсом, резкой адинамией, потерей сознания. Такое состояние возникает вследствие нарушения обмена электролитов, которое приводит к потере ионов Na+ и Сl- с мочой, обезвоживанию за счёт потери внеклеточной жидкости, повышению уровня К+ в сыворотке крови, в межклеточной жидкости и клетках, в результате чего может нарушаться сократительная способность миокарда. Изменение углеводного обмена проявляется в снижении уровня сахара в крови, уменьшении запаса гликогена в печени и скелетных мышцах. Острая недостаточность функции коры надпочечников может быть следствием декомпенсации хронических заболеваний, а также развивается у больных, лечившихся длительное время глюкокортикоидными препаратами по поводу неэндокринных заболеваний, например инфекционно-аллергических заболеваний. В результате длительного приёма глюкокортикоидов подавляется функция гипоталамо-гипофизарно-надпочечниковой системы и развивается атрофия клеток коры надпочечников. Резкая отмена гормональных препаратов может сопровождаться острой надпочечниковой недостаточностью (так называемый синдром "отмены").
Первичная недостаточность надпочечников (болезнь Аддисона)развивается в результате поражения коры надпочечников туберкулёзным или аутоиммунным процессом. Основные клинические проявления выражаются в снижении массы тела, общей слабости, снижении аппетита, тошноте, рвоте, снижении АД и типичной для первичной надпочечниковой недостаточности гиперпигментацйи кожи ("бронзовая болезнь") . Причина гиперпигментации - повышение продукции ПОМК - предшественника АКТГ и меланоцитстимулирующего гормона.
Вторичная недостаточность надпочечниковможет развиться при дефиците АКТГ, что, в свою очередь, может быть следствием опухоли или инфекционного поражения гипофиза. При вторичной недостаточности надпочечников, в отличие от болезни Аддисона, отсутствует гиперпигментация.
При врождённой гиперплазии надпочечниковнарушается синтез кортизола. В 95% случаев при этой патологии обнаруживается дефект 21-гидроксилазы (реже 11-гидроксилазы). Снижение продукции кортизола сопровождается увеличением секреции АКТГ, накоплением промежуточных продуктов синтеза кортикостероидов, в частности, предшественников андрогенов.
Избыток андрогенов ведёт к усилению роста тела, раннему половому созреванию у мальчиков и развитию мужских половых признаков у девочек (адреногенитальный синдром).
При частичной недостаточности 21-гидроксилазы у женщин может нарушаться менструальный цикл.
Гиперпродукция глюкокортикоидов (гиперкортицизм)может быть следствием повышения уровня АКТГ при опухолях гипофиза (болезнь Иценко-Кушинга)и опухолях других клеток (бронхов, тимуса, поджелудочной железы), вырабатывающих кортикотропинподобные вещества, или избыточного синтеза кортизола при гормонально-активных опухолях коры надпочечников (синдром Иценко-Кушинга).
При гиперкортицизме наблюдаются гипергликемия и снижение толерантности к глюкозе, обусловленные стимуляцией глюконеогенеза ("стероидный диабет"), усиление катаболизма белков, уменьшение мышечной массы, истончение кожи, остеопороз, инволюция лимфоидной ткани. Характерно своеобразное перераспределение отложений жира ("лунообразное лицо", выступающий живот). Гипернатриемия, гипертензия, гипокалиемия обусловлены некоторой минералокортикоидной активностью кортизола, которая проявляется при его избытке.ттДля выявления первичной причины гиперкортицизма, помимо определения концентрации АКТГ в плазме крови, используют тесты с применением высоких доз синтетического глюкокортикоида дексаметазона (структурного аналога кортизола). Дексаметазон подавляет секрецию АКТГ по механизму отрицательной обратной связи.иДля болезни Иценко-Кушинга характерно снижение концентрации кортизола после применения дексаметазона более чем на 50%. Отсутствие реакции на введение дексаметазона может указывать на наличие опухоли надпочечников или внегипофизарной секреции АКТГ.
128. Регуляция синтезами секреции гормонов по принципу обратной связи.
Поддержание уровня гормонов в организме обеспечивает механизм отрицательной обратнойсвязи. Изменение концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов, действуя либо на эндокринные железы, либо на гипоталамус. Синтез и секреция тропных гормонов подавляется гормонами эндокринных периферических желёз. Такие петли обратной связи действуют в системах регуляции гормонов надпочечников, щитовидной железы, половых желёз.
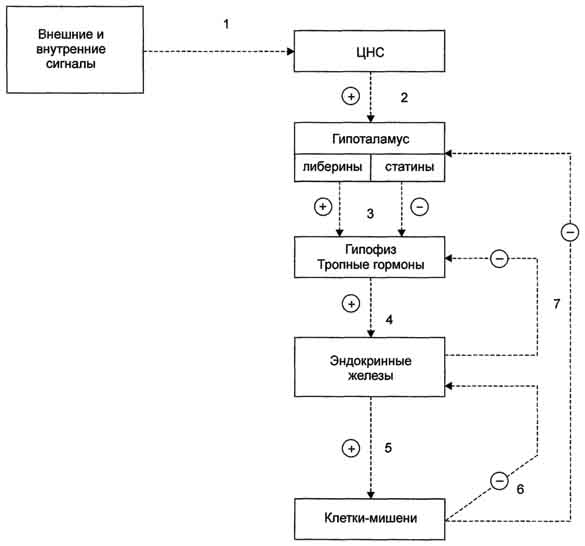
Схема взаимосвязи регуляторных систем организма. 1 - синтез и секреция гормонов стимулируется внешними и внутренними сигналами; 2 - сигналы по нейронам поступают в гипоталамус, где стимулируют синтез и секрецию рилизинг-гормо-нов; 3 - рилизинг-гормоны стимулируют (либерины) или ингибируют (статины) синтез и секрецию тройных гормонов.гипофиза; 4 - тройные гормоны стимулируют синтез и секрецию гормонов периферических эндокринных желез; 5 - гормоны эндокринных желез поступают в кровоток и взаимодействуют с клетками-мишенями; 6 - изменение концентрации метаболитов в клетках-мишенях по механизму отрицательной обратной связи подавляет синтез гормонов эндокринных желез и гипоталамуса; 7 - синтез и секреция тройных гормонов подавляется гормонами эндокринных желез; ⊕ - стимуляция синтеза и секреции гормонов; ⊝ - подавление синтеза и секреции гормонов (отрицательная обратная связь).
129. Половые гормоны: строение, влияние на обмен веществ и функции половых желез, матки и молочных желез.
Половые гормоны — гормоны стероидной природы, определяющие у человека и животных половую дифференцировку в эмбриональном периоде, характер вторичных половых признаков, функциональную активность репродуктивной системы и формирование специфических поведенческих реакций. Они влияют на многие процессы промежуточного обмена, водно-солевой обмен, а также на состояние адаптационных систем организма. К половым гормонам относятся андрогены, эстрогены и прогестины.
Андрогены— мужские половые гормоны, производные андростана, синтезирующиеся в основном в яичках; некоторое количество андрогенов образуется в коре надпочечников и яичниках. Наиболее активный андроген тестостерон по своей химической структуре является стероидом. Биосинтез андрогенов представляет собой ряд последовательных ферментативных превращений холестерина. Основным физиологическим регулятором секреции андрогенов служит лютеинизирующий гормон, взаимодействующий со специфическими циторецепторами. Андрогены, имеющие кетогруппу (СО-группу) при С17, объединяют в группу 17-кетостероидов. В печени андрогены конъюгируются с серной или глюкуроновой кислотами, образуя конъюгаты (парные соединения), которые выводятся с мочой. В крови они содержатся в виде комплексов с липопротеинами, частично в виде свободных глюкуронидов или сульфатов. Тестостерон образуется в яичках, яичниках и надпочечниках. В яичках он продуцируется главным образом клетками Лейдига, в яичниках — тека-клетками овариальных фолликулов, а также в межуточной ткани коркового вещества. В организме взрослого мужчины образуется 4—7 мгтестостерона в сутки, причем около 0,5 мг — в надпочечниках. Яичники и надпочечники взрослой женщины продуцируют примерно 0,5 мгтестостерона в сутки. Основная масса тестостерона, циркулирующего в крови, находится в виде комплекса со специфическим транспортным белком — тестостеронэстрадиолсвязывающим глобулином (ТЭСГ). Связанный с ТЭСГ тестостерон не подвержен метаболическим превращениям. Связывание тестостерона с ТЭСГ служит одним из факторов, определяющих скорость его метаболического клиренса. Метаболические превращения тестостерона осуществляются в печени, почках, кишечнике, легких, коже и других органах. Особое место в его метаболизме принадлежит превращениям в тканях-мишенях. Для метаболического превращения тестостерона в тканях-мишенях характерна 5a-редуктазная реакция, в результате которой образуется 5a-дигидротестостерон. Этот процесс является необходимым этапом биологического действия тестостерона, т.к. именно 5a-дигидроформа связывается с рецепторами тканей-мишеней, 5a-Дигидротестостерон обладает большей андрогенной активностью, чем тестостерон, в связи с чем некоторые исследователи рассматривают тестостерон как прогормон. Биологическое действие тестостерона наиболее специфично в тканях-мишенях, где происходит его избирательное накопление. Рецепторы к тестостерону обнаружены в клетках семенных канальцев, в придатке яичка, предстательной железе, семенных пузырьках, гипоталамусе, матке, фолликулах яичников на определенных стадиях их развития. Андрогенная активность тестостерона проявляется во внутриутробном периоде, когда он, декретируемый яичками плода, обеспечивает половую дифференцировку гипоталамуса, а также формирование внутренних и наружных половых органов по мужскому типу. В период полового созревания под влиянием тестостерона происходит формирование половых органов и развитие вторичных половых признаков. В репродуктивном периоде тестостерон стимулирует определенные этапы сперматогенеза, а также поддерживает половую активность. В женском организме тестостерон оказывает специфическое действие на процессы биосинтеза в клетках матки, а также влияет на развитие фолликулов яичников. Тестостерон обладает выраженным анаболическим действием, связанным со стимуляцией синтеза белка, которое проявляется при формировании фенотипа. Снижение его секреции в мужском организме при гипогонадизме оказывает влияние на формирование наружных половых органов, развитие вторичных половых признаков и сперматогенез. Клиническая симптоматика гипогонадизма во многом определяется степенью недостаточности выработки тестостерона и тем этапом онтогенеза, на котором это нарушение возникло. У женщин повышенная секреция тестостерона надпочечниками (адреногенитальный синдром, вирилизирующие опухоли надпочечников) или яичниками (вирилизирующие опухоли яичников, склерокистозные яичники) приводит к нарушению генеративной функции яичников, а также к вирилизации.
Эстрогены являются производными эстрана, С18-стероидами с ароматическим циклом, фенольной гидроксильной группой при С3 и кетогруппой или гидроксилом при С17. Биосинтез эстрогенов как биохимический процесс представляет собой ароматизацию С19-стероидов, катализируемую комплексом ферментов, локализованных в микросомах. У женщин детородного возраста основная масса эстрогенов синтезируется в яичнике, содержащем зреющий фолликул или желтое тело. Синтез эстрогенов в фолликуле определяется взаимодействием двух стероидпродуцирующих структур зернистого слоя и текаклеток. При этом в последних под регулирующим влиянием лютеинизирующего гормона осуществляется синтез С19-стероидов — андрогенов, которые перемещаются в клетки зернистого слоя, где происходит процесс их ферментативной ароматизации и превращения в эстрогены под контролем фолликулостимулирующего гормона. Синтез эстрогенов в зреющем фолликуле является одним из основных факторов, определяющих функцию гипофизарно-овариальной системы, т.к. повышение концентрации эстрогенов в крови в фазе роста фолликула вызывает преовуляторный выброс лютеинизирующего и фолликулостимулирующего гормонов, которые необходимы для завершения процесса созревания вторичного фолликула и овуляции. Биосинтез эстрогенов путем ароматизации С19-стероидов происходит не только в стероидпродуцирующих железах внутренней секреции, но и во многих тканях организма (жировой ткани, мышцах, печени, почках и др.). В крови эстрогены находятся в основном в виде комплексов с транспортными белками. Образование таких комплексов служит одним из факторов регуляции биологической активности и интенсивности обмена эстрогенов. Основным направлением метаболизма эстрогенов является гидроксилирование стероидного ядра их молекулы в различных положениях. На направленность метаболизма эстрогенов влияет ряд факторов. Так, интенсивность С16-гидроксилирования возрастает при увеличении массы тела, дисфункции печени, снижении концентрациитиреоидных гормонов в крови. Метаболизм эстрогенов происходит в органах-мишенях, почках, коже, эритроцитах и др., однако центральная роль в этом процессе принадлежит печени. Эстрогены, циркулируя в печени, метаболизируются в ней и с желчью попадают в желудочно-кишечный тракт. При этом часть эстрогенов всасывается обратно в кровь, подвергаясь реактивации. В печени образуются водорастворимые конъюгаты эстрогенов и их метаболиты с глюкуроновой и серной кислотами. Кишечно-печеночный цикл и процессы активации — инактивации эстрогенов являются механизмами, регулирующими их обмен и выведение из организма. Нарушение этих механизмов объясняет появление гиперэстрогении у мужчин, больных циррозом печени. Эстрогены и их метаболиты экскретируются с мочой и калом. Физиологический эффект эстрогенов определяется их взаимодействием с рецепторами клеток-мишеней. Рецепторы эстрогенкомпетентных клеток обладают неодинаковым сродством к различным природным и синтетическим эстрогенам. Так, связывание эстрадиола выше, чем синэстрола (гексэстрадиола), эстрона, эстриола (в порядке убывания), что соответствует биологической активности перечисленных эстрогенов в отношении клеток-мишеней. Основное биологическое действие эстрогенов заключается в их влиянии на формирование и функционирование женских половых органов. Эстрогены вызывают увеличение матки за счет роста стромы миометрия и эндометрия, под влиянием эстрогенов осуществляется васкуляризация эндометрия и рост его желез. На протяжении менструального цикла под влиянием меняющегося уровня секреции эстрогенов происходят морфологические изменения слизистой оболочки матки и эпителия влагалища. Под контролем эстрогенов находятся некоторые ключевые этапы яичникового цикла: они дифференцированно влияют на чувствительность клеток зернистого слоя и текаклеток к лютеинизирующему и фолликулостимулирующему гормонам. Эстрогены участвуют в формировании вторичных половых признаков, оказывают модулирующее влияние на различные структуры гипоталамуса, что, в частности, находит выражение в формировании специфического полового поведения. Важную роль играют эстрогены в регуляции функции молочных желез также на жировой обмен, обмен веществ в костной ткани и коже, систему мононуклеарных фагоцитов.
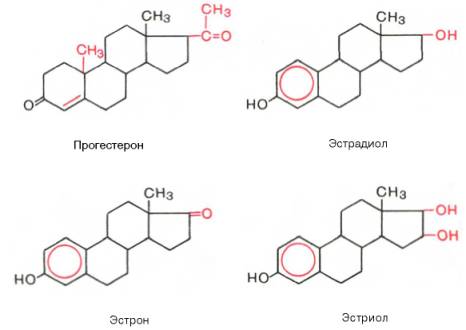
Прогестины. Желтым телом яичника, корой надпочечников, яичками и плацентой синтезируется стероидный гормон прогестерон, который относится к С21 стероидам. Образование прогестерона в яичниках вне беременности регулируется лютеинизирующим гормоном, а при беременности — хорионическим гонадотропином. Механизм действия прогестерона такой же, как у всех стероидных гормонов. Этот гормон взаимодействует со специфическими цитоплазматическими белковыми рецепторами, образуя комплекс, который переносится в ядро клетки и активирует определенные структуры хроматина. В результате стимулируется синтез специфических белков и изменяется функциональное состояние органов-мишеней. Прогестерон участвует в регуляции циклической трансформации эндометрия. Под его влиянием происходят секреторное преобразование эндометрия в лютеиновой фазе менструального цикла, а также функциональные изменения в маточных трубах, влагалище и эпителии молочных желез. Одной из основных физиологических функций прогестерона является торможение сократительной функции миометрия, особенно во время беременности. Снижение секреции прогестерона желтым телом (вне беременности) приводит к недостаточности лютеиновой фазы менструального цикла и к неполноценной секреторной трансформации эндометрия.
130. Гормон роста, строение, функции.
Гормон роста (соматотропин) - пептидный гормон образуется в соматотропных клетках аденогипофиза. Молекула СТГ состоит из 191 аминокислотного остатка (на восемь остатков меньше, чем в молекуле пролактина ) и в отличие от пролактина содержит не три, а два внутримолекулярных дисульфидных мостика
Гормоном роста соматотропин называют за то, что у детей и подростков, а также молодых людей с ещё не закрывшимися зонами роста в костях он вызывает выраженное ускорение линейного (в длину) роста, в основном за счет роста длинных трубчатых костей конечностей. Соматотропин оказывает мощное анаболическое и анти-катаболическое действие, усиливает синтез белка и тормозит его распад, а также способствует снижению отложения подкожного жира, усилению сгорания жира и увеличению соотношения мышечной массы к жировой. Кроме того, соматотропин принимает участие в регуляции углеводного обмена — он вызывает выраженное повышение уровня глюкозы в крови и является одним из контринсулярных гормонов, антагонистов инсулина по действию на углеводный обмен. Описано также его действие на островковые клетки поджелудочной железы, иммуностимулирующий эффект, усиление поглощения кальция костной тканью и др. Многие эффекты гормон роста вызывает непосредственно, но значительная часть его эффектов опосредуется инсулиноподобными факторами роста.
131. Метаболизм эндогенных и чужеродных токсических веществ: реакции микросомального окисления и реакции конъюгации с глутатионом, глюкуроновой кислотой, серной кислотой.
Обезвреживание большинства ксенобиотиков происходит путём химической модификации и протекает в 2 фазы. В результате этой серии реакций ксенобиотики становятся более гидрофильными и выделяются с мочой. Вещества, более гидрофобные или обладающие большой молекулярной массой (>300 кД), чаще выводятся с жёлчью в кишечник и затем удаляются с фекалиями. Сисгема обезвреживания включает множество разнообразных ферментов, под действием которых практически любой ксенобиотик может быть модифицирован. Микросомальные ферменты катализируют реакции С-гидроксилирования, N-гидроксилирования, О-, N-, S-дезалкилирования, окислительного дезаминирования, сульфоокисления и эпоксидирования. В мембранах ЭР практически всех тканей локализована сисгема микросомального окисления (монооксигеназного окисления). В эксперименте при выделении ЭР из клеток мембрана распадается на части, каждая из которых образует замкнутый пузырёк - микросому, отсюда и название - микросомальное окисление. Эта сисгема обеспечивает первую фазу обезвреживания большинства гидрофобных веществ. В метаболизме ксенобиотиков могут принимать участие ферменты почек, лёгких, кожи и ЖКТ, но наиболее активны они в печени. К группе микросомальных ферментов относят специфические оксидазы, различные гидролазы и ферменты конъюгации. Вторая фаза - реакции конъюгации, в результате которых чужеродное вещество, модифицированное ферментными сисгемами ЭР, связывается с эндогенными субстратами - глюкуроновой кислотой, серной кислотой, глицином, глутатионом. Образовавшийся конъюгат удаляется из организма.
Микросомальное окисление.Микросомальные оксидазы - ферменты, локализованные в мембранах гладкого ЭР, функционирующие в комплексе с двумя внемитохондриальными ЦПЭ. Ферменты, катализирующие восстановление одного атома молекулы О2 с образованием воды и включение другого атома кислорода в окисляемое вещество, получили название микросомальных оксидаз со смешанной функцией или микросомальных монооксигеназ. Окисление с участием монооксигеназ обычно изучают, используя препараты микросом.
Основные ферменты микросомальныхэлектронтранспортных цепей. Микросомальная сисгема не содержит растворимых в цитозоле белковых компонентов, все ферменты - мембранные белки, активные центры которых локализованы на цитоплазматической поверхности ЭР. Сисгема включает несколько белков, составляющих электронтранспортные цепи (ЦПЭ). В ЭР существуют две такие цепи, первая состоит из двух ферментов - NADPH-P450 редуктазы и цитохрома Р450, вторая включает фермент NADH-цитохром-b5 редуктазу, цитохром b5 и ещё один фермент - стеароил-КоА-десатуразу.
Электронтранспортная цепь - NADPH-P450 редуктаза - цитохром Р450. В большинстве случаев донором электронов (e) для этой цепи служит NADPH, окисляемый NАDРН-Р450 редуктазой. Фермент в качестве простетической группы содержит 2 кофермента - флавинаденинди-нуклеотид (FAD) и флавинмононуклеотид (FMN). Протоны и электроны с NADPH переходят последовательно на коферменты NADPH-P450 редуктазы. Восстановленный FMN (FMNH2) окисляется цитохромом Р450
Цитохром Р450 - гемопротеин, содержит простетическую группу гем и имеет участки связывания для кислорода и субстрата (ксенобиотика). Название цитохром Р450 указывает на то, что максимум поглощения комплекса цитохрома Р450 лежит в области 450 нм. Окисляемый субстрат (донор электронов) для NADH-цитохром b5 -редуктазы - NADH (см. схему выше). Протоны и электроны с NADH переходят на кофермент редуктазы FAD, следующим акцептором электронов служит Fe3+ цитохрома b5. Цитохром b5 в некоторых случаях может быть донором электронов (e) для цитохрома Р450 или для стеароил-КоА-десатуразы, которая катализирует образование двойных связей в жирных кислотах, перенося электроны на кислород с образованием воды.
NADH-цитохром b5 редуктаза -двухдоменный белок. Глобулярный цитозольный домен связывает простетическую группу - кофермент FAD, а единственный гидрофобный "хвост" закрепляет белок в мембране.
Цитохром b5- гемсодержащий белок, который имеет домен, локализованный на поверхности мембраны ЭР, и короткий "заякоренный" в липидном бислое спирализованный домен.
NADH-цитохром b5 -редуктаза и цитохром b5, являясь "заякоренными" белками, не фиксированы строго на определённых участках мембраны ЭР и поэтому могут менять свою локализацию.
Функционирование цитохрома Р450. Известно, что молекулярный кислород в триплетном состоянии инертен и не способен взаимодействовать с органическими соединениями. Чтобы сделать кислород реакционно-способным, необходимо его превратить в синглетный, используя ферментные системы его восстановления. К числу таковых принадлежит моноксигеназная сисгема, содержащая цитохром Р450. Связывание в активном центре цитохрома Р450 липофильного вещества RH и молекулы кислорода повышает окислительную активность фермента. Один атом кислорода принимает 2 е и переходит в форму О2-. Донором электронов служит NADPH, который окисляется NADPH-цитохром Р450 редуктазой. О2- взаимодействует с протонами: О2- + 2Н+→ Н2О, и образуется вода. Второй атом молекулы кислорода включается в субстрат RH, образуя гидроксильную группу вещества R-OH. Суммарное уравнение реакции гидроксилирования вещества RH ферментами микросомального окисления:
RH + О2 + NADPH + Н+ → ROH + Н2О + NADP+ .
Субстратами Р450 могут быть многие гидрофобные вещества как экзогенного (лекарственные препараты, ксенобиотики), так и эндогенного (стероиды, жирные кислоты и др.) происхождения. Таким образом, в результате первой фазы обезвреживания с участием цитохрома Р450 происходит модификация веществ с образованием функциональных групп, повышающих растворимость гидрофобного соединения. В результате модификации возможна потеря молекулой её биологической активности или даже формирование более активного соединения, чем вещество, из которого оно образовалось.
Свойства системы микросомальногоокисления. Важнейшие свойства ферментов микросомального окисления: широкая субстратная специфичность, которая позволяет обезвреживать самые разнообразные по строению вещества, и регуляция активности по механизму индукции.
Участие трансферам в реакциях конъюгации.Все ферменты, функционирующие во второй фазе обезвреживания ксенобиотиков, относят к классу трансфераз. Они характеризуются широкой субстратной специфичностью.
УДФ-глюкуронилтрансферазы
Локализированные в основном в ЭР уридин-дифосфат (УДФ)-глюкуронилтрансферазы присоединяют остаток глюкуроновой кислоты к молекуле вещества, образованного в ходе микросомального окисления.
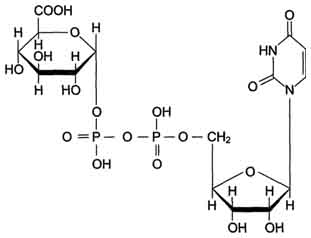
В общем виде реакция с участием УДФ-глюкуронилтрансферазы записывается так:
ROH + УДФ-С6Н9О6 = RO-C6H9O6 + УДФ.
Сульфотрансферазы
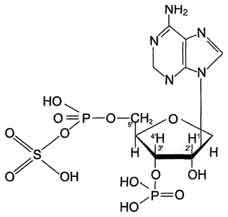
Цитоплазматические cульфотрансферазы катализируют реакцию конъюгации, в ходе которой остаток серной кислоты (-SO3H) от 3'-фосфоаденозин-5'-фосфосульфата (ФАФС) присоединяется к фенолам, спиртам или аминокислотам Реакция с участием сульфотрансферазы в общем виде записывается так:
ROH + ФАФ-SO3H = RO-SO3H + ФАФ.
Ферменты сульфотрансферазы и УДФ-глюкуронилтрансферазы участвуют в обезвреживании ксенобиотиков, инактивации лекарств и эндогенных биологически активных соединений.
Глутатионтрансферазы
Особое место среди ферментов, участвующих в обезвреживании ксенобиотиков, инактивации нормальных метаболитов, лекарств, занимают глутатионтрансферазы (ГТ). Глутатионтрансферазы функционируют во всех тканях и играют важную роль в инактивации собственных метаболитов: некоторых стероидных гормонов, простагландинов, билирубина, жёлчных кислот, продуктов ПОЛ. Известно множество изоформ ГТ с различной субстратной специфичностью. В клетке ГТ в основном локализованы в цитозоле, но имеются варианты ферментов в ядре и митохондриях. Для работы ГТ требуется глутатион (GSH).
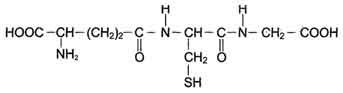
Глутатион - трипептид Глу-Цис-Гли (остаток глутаминовой кислоты присоединён к цис-теину карбоксильной группой радикала).
ГТ обладают широкой специфичностью к субстратам, общее количество которых превышает 3000. ГТ связывают очень многие гидрофобные вещества и инактивируют их, но химической модификации с участием глугатиона подвергаются только те, которые имеют полярную группу. То есть субстратами служат вещества, которые, с одной стороны, имеют электрофильный центр (например, ОН-группу), а с другой стороны - гидрофобные зоны. Обезвреживание, т.е. химическая модификация ксенобиотиков с участием ГТ, может осуществляться тремя различными способами:
- путём конъюгации субстрата R с глутатионом (GSH):
R + GSH → GSRH,
- в результате нуклеофильного замещения:
RX + GSH → GSR + НХ,
- восстановления органических пероксидов до спиртов:
R-HC-O-OH + 2 GSH → R-HC-OH + GSSG + H2O
Сисгема обезвреживания с участием ГТ и глутатиона играет уникальную роль в формировании резистентности организма к самым различным воздействиям и является наиболее важным защитным механизмом клетки. В ходе биотрансформации некоторых ксенобиотиков под действием ГТ образуются тиоэфиры (конъюгаты RSG), которые затем превращаются в меркаптаны, среди которых обнаружены токсические продукты. Но конъюгаты GSH с большинством ксенобиотиков менее реакционно-способны и более гидрофильны, чем исходные вещества, а поэтому менее токсичны и легче выводятся из организма. ГТ своими гидрофобными центрами могут нековалентно связывать огромное количество ли-пофильных соединений (физическое обезвреживание), предотвращая их внедрение в липидный слой мембран и нарушение функций клетки. Поэтому ГТ иногда называют внутриклеточным альбумином. ГТ могут ковалентно связывать ксенобиотики, являющиеся сильными электролитами. Присоединение таких веществ - "самоубийство" для ГТ, но дополнительный защитный механизм для клетки.
132. Металлотионеин и обезвреживание ионов тяжелых металлов. Белки теплового шока.
Металлотионеин - небольшой, обогащенный цистеином белок, способный связывать двухвалентные металлы. Роль металлотионеина состоит в регуляции концентрации в клетке таких микроэлементов, как цинк и медь , а также в связывании ядовитых тяжелых металлов , например, кадмия и ртути благодаря способности образовывать хелатные соединения с ионами тяжелых металлов. Отравление клеток организма тяжелыми металлами сопровождается накоплением металлотионеина благодаря усилению транскрипции гена (в культурах клеток описаны случаи амплификации этого гена, определяющей их устойчивость к ядам). Геном млекопитаюших содержит несколько генов металлотионеина, различающихся особенностями регуляции.
Белки теплового шока — это класс функционально сходных белков, экспрессия которых усиливается при повышении температуры или при другихстрессирующих клетку условиях. Повышение экспрессии генов, кодирующих белки теплового шока, регулируется на этапе транскрипции. Чрезвычайное усиление экспрессии генов, кодирующих белки теплового шока является частью клеточного ответа на тепловой шок и вызывается в основном фактором теплового шока (HSF англ. heat shock factor). Белки теплового шока обнаружены в клетках практически всех живых организмов, от бактерий до человека. Высокие уровни белков теплового шока в клетке наблюдают после воздействия различных стрессирующих факторов — при инфекциях, воспалительных процессах, внешних воздействиях токсинов (этанол, мышьяк, тяжелые металлы), при ультрафиолетовом облучении, голодании, гипоксии, недостатке азота (у растений) или нехватке воды. Белки теплового шока называют белками стресса, так как повышение экспрессии соответствующих генов часто наблюдается при ответе на стресс.
Точный механизм, по которому тепловой шок активирует экспрессию генов белков теплового шока, не выяснен. Однако, некоторые исследования свидетельствуют о том, что активация белков теплового шока происходит неправильно сложенными или поврежденными белками.
Шапероны.Белки теплового шока действуют как внутриклеточные шапероны в отношении других белков. Белки теплового шока играют важную роль в белок-белковых взаимодействиях, например, при фолдинге и сборке сложных белков, препятствуют нежелательной агрегации белков. Белки теплового шока стабилизируют частично свернутые белки и облегчают их транспорт через мембраны внутри клетки. Некоторые белки теплового шока экспрессируются в малых или умеренных количествах во всех типах клеток всех живых организмов, так как играют ключевую роль в существовании белков.
Внутриклеточные функции.Белки теплового шока присутствуют в клетках и при нестрессовых условиях, как бы следят за белками в клетке. Белки теплового шока утилизируют старые белки в составепротеасомы и помогат корректно свернуться заново синтезированным белкам.
Сердечно-сосудистая система. По-видимому, белки теплового шока играют важную роль в сердечно-сосудистой системе. Для белков теплового шока hsp90, hsp84, hsp70, hsp27, hsp20, и альфа-B-кристаллин показана роль деятельности сердечно-сосудистой системы. Hsp90 связывает эндотелиальную синтетазу оксида азота и гуанилатциклазу, которые в свою очередь участвуют в расслаблении сосудов. В системе передачи сигнала при помощи оксида азота далее протеинкиназа G фосфорилирует малый белок теплового шока, hsp20, который принимает участие в расслаблении гладких мышц. Hsp20 по-видимому, играет важную роль в развитии гладких мышц и предотвращает агрегацию тромбоцитов, предотвращает апоптоз после ишемического инсульта, а также имеет значение в функционировании скелетных мышц и ответе мышц на инсулин. Hsp27 является главным фосфопротеином при мышечном сокращении.
Иммунитет. Внеклеточные и связанные с плазматической мембраной, белки теплового шока, и особенно Hsp70, участвуют в связывании и презентации антигенов.
133. Токсичность кислорода: образование активных форм кислорода (супероксид анион, перекись водорода, гидроксильный радикал).
Кислород, необходимый организму для функци
Дата добавления: 2016-12-26; просмотров: 3980;
