Переваривание белков в кишечнике. 1 страница
Желудочное содержимое (химус) в процессе переваривания поступает в двенадцатиперстную кишку. Низкое значение рН химуса вызывает в кишечнике выделение белкового гормона секретина, поступающего в кровь. Этот гормон в свою очередь стимулирует выделение из поджелудочной железы в тонкий кишечник панкреатического сока, содержащего НСО3-, что приводит к нейтрализации НСl желудочного сока и ингибированию пепсина. В результате рН резко возрастает от 1,5-2,0 до ∼7,0. Поступление пептидов в тонкий кишечник вызывает секрецию другого белкового гормона - холецистокинина, который стимулирует выделение панкреатических ферментов с оптимумом рН 7,5-8,0. Под действием ферментов поджелудочной железы и клеток кишечника завершается переваривание белков.
Активация панкреатических ферментовВ поджелудочной железе синтезируются проферменты ряда протеаз: трипсиноген, химотрипсиноген, проэластаза, прокарбоксипептидазы А и В. В кишечнике они путём частичного протеолиза превращаются в активные ферменты трипсин, химотрипсин, эластазу и карбоксипептидазы А и В.
Активация трипсиногенапроисходит под действием фермента эпителия кишечника энтеропептидазы. Этот фермент отщепляет с N-конца молекулы трипсиногена гексапептид Вал-(Асп)4-Лиз. Изменение конформации оставшейся части полипептидной цепи приводит к формированию активного центра, и образуется активный трипсин. Последовательность Вал-(Асп)4-Лиз присуща большинству известных трипсиноге-нов разных организмов - от рыб до человека.
Образовавшийся трипсин активирует химотрипсиноген,из которого получается несколько активных ферментов (рис. 9-3). Химотрипсиноген состоит из одной полипептидной цепи, содержащей 245 аминокислотных остатков и пяти дисульфидных мостиков. Под действием трипсина расщепляется пептидная связь между 15-й и 16-й аминокислотами, в результате чего образуется активный π-химотрипсин. Затем под действием π-химотрипсина отщепляется дипептид сер(14)-арг(15), что приводит к образованию δ-химотрипсина. Отщепление дипептида тре(147)-арг(148) завершает образование стабильной формы активного фермента - α-химотрипсина, который состоит из трёх полипептидных цепей, соединённых дисульфидными мостиками. Остальные проферменты панкреатических протеаз (проэластаза и прокарбоксипептидазы А и В) также активируются трипсином путём частичного протеолиза. В результате образуются активные ферменты - эластаза и карбокси-пептидазы А и В.
Специфичность действия протеаз. Трипсин преимущественно гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. Химотрипсины наиболее активны в отношении пептидных связей, образованных карбоксильными группами ароматических аминокислот (Фен, Тир, Три). Карбоксипептидазы А и В - цинксодержащие ферменты, отщепляют С-концевые остатки аминокислот. Причём карбоксипептидаза А отщепляет преимущественно аминокислоты, содержащие ароматические или гидрофобные радикалы, а карбоксипептидаза В - остатки аргинина и лизина. Последний этап переваривания - гидролиз небольших пептидов, происходит под действием ферментов аминопептидаз и дипептидаз, которые синтезируются клетками тонкого кишечника в активной форме.
· Аминопептидазы последовательно отщепляют N-концевые аминокислоты пептидной цепи. Наиболее известна лейцинаминопептидаза - Zn2+- или Мn2+-содержащий фермент, несмотря на название, обладающий широкой специфичностью по отношению к N-концевым аминокислотам.
· Дипептидазырасщепляют дипептиды на аминокислоты, но не действуют на трипептиды.
В результате последовательного действия всех пищеварительных протеаз большинство пищевых белков расщепляется до свободных аминокислот.
Экзопептидазы (экзопротеиназы) — ферменты, гидролизующие белки, отщепляя аминокислоты от конца пептида: карбоксипептидазы — от C-конца, аминопептидазы — от N-конца, дипептидазы расщепляют дипептиды. Экзопептидазы синтезируются в клетках тонкого кишечника (аминопептидазы, дипептидазы) и в поджелудочной железе (карбоксипептидаза). Функционируют эти ферменты внутриклеточно в кишечном эпителии и, в небольшом количестве, в просвете кишечника.
Эндопептидазы (эндопротеиназы) — протеолитические ферменты (пепсин, трипсин, химотрипсин), расщепляющие пептидные связи внутри пептидной цепи. С наибольшей скоростью ими гидролизуются связи, образованные определёнными аминокислотами. Эндопептидазы синтезируются в виде проферментов, активируемых затем при помощи избирательного протеолиза. Таким образом клетки, секретирующие эти ферменты защищают собственные белки от разрушения. От действия ферментов клеточную мембрану клеток животных защищает также поверхностный слой олигосахаридов —гликокаликс, а в кишечнике и желудке — слой слизи.
76. Диагностическое значение биохимического анализа желудочного и дуоденального сока. Дать краткую характеристику состава этих соков.
Желудочный сок — сложный по составу пищеварительный сок, вырабатываемый различными клетками слизистой оболочки желудка. Желудочный сок содержит соляную кислоту и ряд минеральных солей, а также различные ферменты, главнейшими из которых являются пепсин, расщепляющий белки, химозин (сычужный фермент), створаживающий молоко, липаза, расщепляющая жиры. Составной частью желудочного сока является также слизь, играющая важную роль в защите слизистой оболочки желудка от раздражающих веществ, попавших в него; при высокой кислотности желудочного сока слизь нейтрализует ее.
Кроме соляной кислоты, ферментов, солей и слизи, в желудочном соке содержится также особое вещество — т. наз. внутренний фактор Касла. Это вещество необходимо для всасывания витамина В12 в тонких кишках, что обеспечивает нормальное созревание красных кровяных телец в костном мозге. При отсутствии фактора Касла в желудочном соке, что обычно связано с заболеванием желудка, а иногда с его оперативным удалением, развивается тяжелая форма малокровия. Анализ желудочного сока является очень важным методом исследования больных с заболеваниями желудка, кишечника, печени, желчного пузыря, крови и пр
|
Дуоденальный сок - пищеварительный сок двенадцатиперстной кишки, состоящий из секрета поджелудочной железы, желчи, сока кишечных крипт и дуоденальных желез.
77. Протеиназы поджелудочной железы и панкреатиты. Применение ингибиторов протеиназ для лечения панкреатитов.
Панкреатический сок имеет высокую концентрацию бикарбонатов, которые обусловливают его щелочную реакцию. Его рН колеблется от 7,5 до 8,8. В соке содержатся хлориды натрия, калия и кальция, сульфаты и фосфаты. Вода и электролиты выделяются в основном центроацинарными и эпителиальными клетками выводах протоков. В состав сока входит и слизь, которая вырабатывается бокаловидными клетками главного протока поджелудочной железы. Панкреатический сок богат ферментами, осуществляющими гидролиз белков, жиров и углеводов. Они вырабатываются ацинарными панкреацитами.
Протеолитические ферменты (трипсин, химотрипсин, эластаза, карбок-сипептидазы А и В) выделяются панкреацитами в неактивном состоянии, что предотвращает самопереваривание клеток.
Трипсин. Трипсиноген и трипсин получены в кристаллическом виде, полностью расшифрована их первичная структура и известен молекулярный механизм превращения профермента в активный фермент. В опытах in vitro превращение трипсиногена в трипсинкатализируют не только энтеропептидаза и сам трипсин, но и другие протеиназы и ионы Са2+.
Активирование трипсиногена химически выражается в отщеплении с N-конца полипептидной цепи 6 аминокислотных остатков (Вал–Асп– Асп–Асп–Асп–Лиз) и соответственно в укорочении полипептидной цепи.
Следует подчеркнуть, что в этом небольшом, казалось бы, химическом процессе – отщепление гексапептида от предшественника – заключено важное биологическое значение, поскольку при этом происходят формирование активного центра и образование трехмерной структуры трипсина, а известно, что и белки биологически активны только в своей нативной трехмерной конформации. В том, что трипсин, как и другие протеиназы, вырабатывается в поджелудочной железе в неактивной форме, также имеется определенный физиологический смысл, поскольку в противном случае трипсин мог бы оказывать разрушающее протеолитическое действие не только на клетки самой железы, но и на другие ферменты, синтезируемые в ней (амилаза, липаза и др.). В то же время поджелудочная железа защищает себя еще одним механизмом – синтезом специфического белка ингибитора панкреатическоготрипсина. Этот ингибитор оказался низкомолекулярным пептидом (мол. масса 6000), который прочно связывается с активными центрами трипсина и химотрипсина, вызывая обратимое их ингибирование. В поджелудочной железе синтезируется также α1-антипротеиназа (мол. масса 50000), которая преимущественно инги-бирует эластазу.
При остром панкреатите, когда трипсин и другие ферменты из пораженной поджелудочной железы «вымываются» в кровь, уровень их вкрови соответствует размерам некротического участка. В этом случае определение активности трипсина в сыворотке крови является надежным ферментным тестом при диагностике острого панкреатита. Следует отметить, что субстратная специфичность трипсинаограничена разрывом только тех пептидных связей, в образовании которых участвуют карбоксильные группы лизина и аргинина.
Химотрипсин. В поджелудочной железе синтезируется ряд химотрип-синов (α-, β- и π-химотрипсины) из двух предшественников – химотрипсиногена А и химотрипсиногена В. Активируются проферменты в кишечнике под действием активного трипсина ихимотрипсина. Полностью раскрыта последовательность аминокислот химотрипсиногена А, во многом сходная с последовательностьюаминокислот трипсина. Молекулярная масса его составляет примерно 25000. Он состоит из одной полипептидной цепи, содержащей 246 аминокислотных остатков. Активация профермента не сопряжена с отщеплением большого участка молекулы. Получены доказательства, что разрыв одной пептидной связи между аргинином и изолейцином в молекуле химотрипсиногена А под действием трипсина приводит к формированию π-химотрипсина, обладающего наибольшей ферментативной активностью. Последующее отщепление дипеп-тида Сер–Арг приводит к образованию δ-химотрипсина. Аутокаталити-ческий процесс активирования, вызванный химотрипсином, сначала способствует формированию неактивного промежуточного неохимотрипсина, который под действием активного трипсина превращается в α-химотрип-син; этот же продукт образуется из δ-химотрипсина, но под действием активного химотрипсина. Таким образом, благодаря совместному перекрестному воздействию химотрипсина и трипсина из химотрипсиногена образуются разные химо-трипсины, различающиеся как ферментативной активностью, так и некоторыми физико-химическими свойствами, в частности электрофорети-ческой подвижностью. Следует отметить, что химотрипсин обладает более широкой субстратной специфичностью, чем трипсин. Он катализирует гидролиз не только пептидов, но и эфиров, гидроксаматов, амидов и других ацилпроизводных, хотя наибольшую активность химотрипсин проявляет по отношению к пептидным связям, в образовании которых принимают участие карбоксильные группы ароматических аминокислот:фенилаланина, тирозина и триптофана.
Эластаза. В поджелудочной железе синтезируется еще одна эндопеп-тидаза – эластаза – в виде проэластазы. Превращениепрофермента в эластазу в тонкой кишке катализируется трипсином. Название фермент получил от субстрата эластина, который он гидролизует. Эластин содержится в соединительной ткани и характеризуется наличием большого числа остатков глицина и серина. Эластаза обладает широкой субстратной специфичностью, но предпочтительнее гидролизует пептидные связи, образованныеаминокислотами с небольшими гидрофобными радикалами, в частности глицином, аланином и серином. Интересно, что ни трипсин, нихимотрипсин не гидролизуют пептидные связи молекулы эластина, хотя все три фермента, включая эластазу, содержат сходные участкиаминокислотных последовательностей и одинаковые места положения дисульфидных мостиков, а также имеют в активном центре один и тот же ключевой остаток серина, что подтверждают опыты с ингибированием всех трех ферментовдиизопропилфторфосфатом, химически связывающим ОН-группу серина. Высказано предположение, что все три эндопептидазы поджелудочной железы: трипсин, химотрипсин и эластаза,– возможно, имеют один и тот же общий предшественник и чтоспецифичность активного фермента в основном определяется конформационными изменениями профермента в процессе активирования.
Экзопептидазы. В переваривании белков в тонкой кишке активное участие принимает семейство экзопептидаз. Одни из них – карбоксипеп-тидазы – синтезируются в поджелудочной железе в виде прокарбоксипеп-тидазы и активируются трипсином в кишечнике; другие – аминопептидазы – секретируются в клетках слизистой оболочки кишечника и также активируются трипсином.
Карбоксипептидазы. Подробно изучены две карбоксипептидазы – А и В, относящиеся к металлопротеинам и катализирующие отщепление от полипептида С-концевых аминокислот. Карбоксипептидаза А разрывает преимущественно пептидные связи, образованные концевыми ароматическими аминокислотами, а карбоксипептидаза В – связи, в образовании которых участвуют С-концевые лизин и аргинин. Очищенный препарат карбокси-пептидазы А обладает бифункциональной активностью – пептидазной и эстеразной и содержит ион Zn2+(один атом на 1 моль фермента). При замене ионов Zn2+на ионы Са2+ полностью утрачивается пепти-дазная активность, но усиливается исходная эстеразная активность, хотя
при этом существенных изменений в третичной структуре фермента не отмечается.
Аминопептидазы. В кишечном соке открыты два фермента – аланин-аминопептидаза, катализирующая преимущественно гидролизпептидной связи, в образовании которой участвует N-концевой аланин, и лейцин-аминопептидаза, не обладающая строгой субстратнойспецифичностью и гидролизующая пептидные связи, образованные любой N-концевой аминокислотой. Оба фермента осуществляют ступенчатое отщепление аминокислот от N-конца полипептидной цепи.
Дипептидазы. Процесс переваривания пептидов, их расщепление до свободных аминокислот в тонкой кишке завершают дипептидазы. Среди дипептидаз кишечного сока хорошо изучена глицилглицин-дипептидаза, гидролизующая соответствующий дипептид до двухмолекул глицина. Известны также две другие дипептидазы: пролил-дипептидаза (пролиназа), катализирующая гидролиз пептидной связи, в образовании которой участвует СООН-группа пролина, и пролин-дипептидаза (пролидаза), гидроли-зующая дипептиды, в которых азот пролина связан кислотно-амидной связью.
78. Трансаминирование: аминотрансферазы; коферментная функция витамина В6. Специфичность аминотрансфераз.
Из реакции переноса NH2 наиболее важны реакции трансаминирования . Они катализируются трансаминазами и участвуют в катаболических и анаболических процессах с участием аминокислот. При трансаминировании аминогруппа аминокислоты(аминокислота 1) переносится на 2-кетокислоту (кетокислота 2). Из аминокислоты при этом образуется 2-кетокислота (а), а из первоначальной кетокислоты — аминокислота (b). Переносимая NH2-группа временно присоединяется к связанному с ферментомпиридоксальфосфату , который вследствие этого переходит в пиридоксаминофосфат.
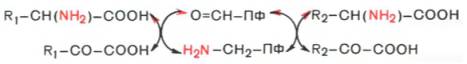
Механизм трансаминирования. В отсутствие субстратов альдегидная группа пиридоксальфосфата ковалентно связана с остатком лизина трансаминазы (1). Этот тип соединения, найденный также в родопсинах (см. с. 346), относится к альдиминам или шиффовым основаниям, во время реакции аминокислота 1 вытесняет остаток лизина и образуется новый альдимин (2). Затем за счет изомеризации происходит перемещение двойной связи. Полученный кетимин (3) гидролизуется до 2-кетокислоты и пиридоксаминфосфата (4). На второй частиреакции те же стадии протекают в противоположном направлении: пиридоксаминфосфат и вторая 2-кетокислота образуют кетимин, который иэомеризуется в альдимин. Наконец, отщепляется вторая аминокислота и регенерируется кофермент.
Аминотрансфера́зы(трансаминазы) — ферменты из группы трансфераз, переносящие аминогруппы без образования свободного аммиака. Аминотрансферазы также называют трансаминазами, а реакцию — трансаминированием. Для аминотрансфераз донором аминогрупп являются аминокислоты, а акцептором — кетокислоты:
AK1 + KK2 ↔ KK1 + AK2
В составе простетической группы аминотрансферазы содержат производные витамина B6. Во время переноса аминогруппы простетическая группа переходит из пиридоксаль-5-фосфатной формы в пиридосамино-5-фосфатную форму. Механизм реакции трансаминирования открыт в 1937 году советскими учеными А.Е. Браунштейном и М.Г.Крицман. Процесс протекает в две стадии. Альдегидная группа пиридоксальфостфата (-СНО) взаимодействует с аминогруппой аминокислоты с образованием иминной связи в основании Шиффа: сначала α-аминогруппа аминокислоты-донора замещает ε-аминогруппуапофермента, а затем происходит перегруппировка через кетимин и в результате гидролиза образуется пиридосамино-5-фосфат и α-кетокислота. Реакции повторяются в обратном порядке
Аминотрансферазы являются каталитически совершенными ферментами. Аминотрансферазы содержаться практически во всех органах, но наиболее активно реакции трансаминирования идут в печени. К этой группе ферментов относятся такие важные для клинической лабораторной диагностики ферменты, как АСТ и АЛТ.
Пиридоксальфосфат является простетической группой аминотранс-фераз, катализирующих обратимый перенос аминогруппы (NH2-группы) от аминокислот на α-кетокислоту, и декарбоксилаз аминокислот, осуществляющих необратимое отщепление СО2 от карбоксильной группы аминокислот с образованием биогенных аминов. Установлена кофер-ментная роль пиридоксальфосфата в ферментативных реакцияхнеокислительного дезаминирования серина и треонина, окисления триптофана, кинуренина, превращения серосодержащих аминокислот, взаимопревращения серина и глицина, а также в синтезе δ-аминолевулиновой кислоты, являющейсяпредшественником молекулы гема гемоглобина. В последние годы число вновь открытых пиридокса-левых ферментов быстро увеличивалось. Так, для действия гликогенфос-форилазы существенной оказалась фосфорильная, а не альдегидная группа пиридоксальфосфата. Вследствие широкого участия пиридоксальфосфата в процессах обмена при недостаточности витамина В6 отмечаются разнообразные нарушения метаболизма аминокислот.
79. Аминокислоты, участвующие в трансаминировании; особая роль глутаминовой кислоты. Биологическое значение реакций трансаминирования. Определение трансаминаз в сыворотке крови при инфаркте миокарда и болезнях печени.
Чрезвычайно широкое распространение трансаминаз в животных тканях, у микроорганизмов и растений, их высокая резистентность к физическим, химическим и биологическим воздействиям, абсолютная стереохимическая специфичность по отношению к L-аминокислотам, а также высокая каталитическая активность в процессах трансаминирования послужили предметом детального исследования роли этих ферментов в обмене аминокислот. Ранее было указано, что при физиологических значениях рН средыактивность оксидазы L-аминокислот резко снижена. Учитывая это обстоятельство, а также высокую скорость протекания реакциитрансами-нирования, А.Е. Браунштейн выдвинул гипотезу о возможности существования в животных тканях непрямого путидезаминирования аминокислот через реакции трансаминирования, названного им трансдезаминированием.Основой для выдвижения этой гипотезы послужили также данные Г. Эйлера о том, что в животных тканях из всех природных аминокислот с высокой скоростью дезаминируется только L-глутаминовая кислота в реакции, катализируемой высокоактивной и специфической глутамат-дегидрогеназой.
Согласно гипотезе, получившей экспериментальное подтверждение, все или почти все природные аминокислоты (исключение составляет метионин) сначала реагируют с α-кетоглутаровой кислотой в реакции трансами-нирования с образованием глутаминовой кислоты и соответствующей кетокислоты. Образовавшаяся глутаминовая кислота затем подвергается непосредственному окислительному дезаминированию под действием глу-таматдегидрогеназы. Суммарная реакция при этом следующая:
R,—CH(NH2)—COOH + НАД++H20-> R,—CO—СООН + НАДН2 + NH3.
Поскольку обе реакции (трансаминирование и дезаминирование глу-таминовой кислоты) являются обратимыми, создаются условия для синтеза по существу любой аминокислоты, если в организме имеются соответствующие α-кетокислоты. Известно, что организмживотных и человека не наделен способностью синтеза углеродных скелетов (α-кетокислот), так называемых незаменимыхаминокислот; этой способностью обладают только растения и многие микроорганизмы. Механизм, при помощи которого в живых организмах осуществляется синтез природных аминокислот из α-кетокислот и аммиака, был назван А.Е. Браунштейном трансреаминированием. Сущность его сводится к восстановительному аминированию α-кетоглутаровойкислоты с образованием глутаминовой кислоты (реакцию катализирует НАДФ-зависимая глута-матдегидрогеназа, работающая в режиме синтеза) и к последующему трансаминированию глутамата с любой α-кетокислотой. В результате образуется L-аминокислота, соответствующая исходной кетокислоте, и вновь освобождается α-кетоглутаровая кислота, которая может акцептировать новуюмолекулу аммиака. Таким образом, трансаминазы катализируют опосредованное через глутаматдегидрогеназу дезаминирование природных аминокислот и биосинтез аминокислот .
Получены доказательства существования в организме теплокровных животных еще одного механизма непрямого (опосредованного) дезаминирования L-аминокислот, при котором Глу, Асп и АМФ выполняют роль системы переноса NН2-группы; гидролитическоедезаминирование АМФ приводит к образованию инозинмонофосфата (ИМФ) и аммиака:
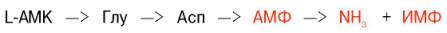
Возможно, что в аналогичной системе в качестве промежуточного переносчика NH2-группы вместо АМФ участвует НАД.
Клиническое значение определения активности трансаминаз. Широкое распространение и высокая активность трансаминаз в органах и тканях человека, а также сравнительно низкие величины активности этих ферментов в крови послужили основанием для определения уровня ряда трансаминаз в сыворотке крови человека при органических и функциональных поражениях разных органов. Для клинических целей наибольшее значение имеют две трансаминазы – аспартат-аминотрансфераза (AcAT)и аланин-аминотрансфераза (АлАТ), катализирующие соответственно следующие обратимые реакции:
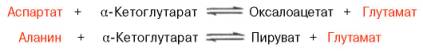
В сыворотке крови здоровых людей активность этих трансаминаз в тысячи раз ниже, чем в паренхиматозных органах. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающиеся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. Так, уже через 3–5 ч после развития инфаркта миокарда уровень АсАТ в сыворотке кровирезко повышается (в 20–30 раз). Максимум активности обеих трансаминаз крови приходится на конец первых суток, а уже через 2–3 дня при благоприятном исходе болезни уровень сывороточных трансаминаз возвращается к норме. Напротив, при затяжном процессе или наступлении повторного инфаркта миокарда наблюдается новый пик повышения активности этих ферментов в крови. Этим объясняется тот факт, что в клинике трансаминазный тест используется не только для постановки диагноза, но и для прогноза и проверки эффективности лечения . При поражениях клеток печени, например при гепатитах, также наблюдается гипертрансаминаземия (за счет преимущественного повышения уровня АлАТ), но она имеет более умеренный и затяжной характер, а повышение активноститрансаминазы в сыворотке крови происходит медленно. При различного рода коронарной недостаточности (стенокардия, пороки сердца и др., кроме инфаркта миокарда) гипертрансаминаземия или не наблюдается, или незначительна. Определение активноститрансаминаз в сыворотке крови при заболеваниях сердца следует отнести к дифференциально-диагностическим лабораторным тестам. Повышение уровня трансаминаз в сыворотке крови отмечено, кроме того, при некоторых заболеваниях мышц, в частности при обширных травмах, гангрене конечностей и прогрессивной мышечной дистрофии.
80. Окислительное дезаминирование аминокислот; глутаматдегидрогеназа. Непрямое дезаминирование аминокислот. Биологическое значение.
Дезаминирование аминокислот -реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. Аммиак токсичен для ЦНС, поэтому в организме человека и млекопитающих он превращается в нетоксичное хорошо растворимое соединение - мочевину. В виде мочевины, а также в виде солей аммония аммиак выводится из организма. Безазотистый остаток используется для образования аминокислот в реакциях трансаминирования, в процессах глюконеогенеза, кето-генеза, в анаплеротических реакциях для восполнения убыли метаболитов ОПК, в реакциях окисления до СО2 и Н2О.
Существует несколько способов дезаминирования аминокислот:
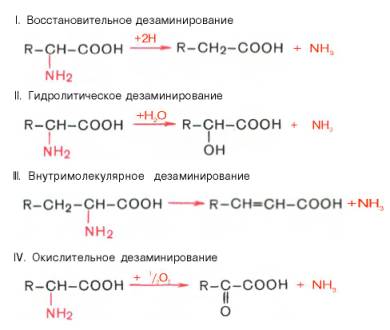
Окислительное дезаминирование.Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа,коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат. Окислительное дезаминирование глутамата-обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное шинирование α-кетоглутарата.Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД). Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДф активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образованиеα-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
Оксидаза L-аминокислот.В печени и почках обнаружен фермент оксидаза L-аминокислот,способный дезаминировать некоторые L-аминокислоты. Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислоттакже обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры.
Дата добавления: 2016-12-26; просмотров: 2000;
