Реакции аэробного гликолиза
Превращение глюкозо-6-фосфата в 2 молекулы глицеральдегид-3-фосфата Глюкозо-6-фосфат, образованный в результате фосфорилирования глюкозы с участием АТФ, в ходе следующей реакции превращается в фруктозо-6-фосфат. Эта обратимая реакция изомеризации протекает под действием фермента глюкозофосфатизомеразы.
Затем следует ещё одна реакция фосфорилирования с использованием фосфатного остатка и энергии АТФ. В ходе этой реакции, катализируемой фосфофруктокиназой, фруктозо-6-фосфат превращается в фруктозо-1,6-бисфосфат. Данная реакция, так же, как гексокиназная, практически необратима, и, кроме того, она наиболее медленная из всех реакций гликолиза. Реакция, катализируемая фосфофруктокиназой, определяет скорость всего гликолиза, поэтому, регулируя активность фосфофруктокиназы, можно изменять скорость катаболизма глюкозы.
Фруктозо-1,6-бисфосфат далее расщепляется на 2 триозофосфата: глицеральдегид-3-фосфат и дигидроксиацетонфосфат. Реакцию катализирует фермент фруктозобисфосфатальдолаза,или просто альдолаза.Этот фермент катализирует как реакцию альдольного расщепления, так и альдольной конденсации, т.е. обратимую реакцию. Продукты реакции альдольного расщепления - изомеры. В последующих реакциях гликолиза используется только глицеральдегид-3-фосфат, поэтому дигидроксиацетонфосфат превращается с участием фермента триозофосфатизомеразы в глицероальдегид-3-фосфат. В описанной серии реакций дважды происходит фосфорилирование с использованием АТФ. Однако расходование двух молекул АТФ (на одну молекулу глюкозы) далее будет компенсировано синтезом большего количества АТФ
Превращение глицеральдегид-3-фосфата в пируват Эта часть аэробного гликолиза включает реакции, связанные с синтезом АТФ. Наиболее сложной в данной серии реакций является реакция превращения глицеральдегид-3-фосфата в 1,3-бисфосфоглицерат. Это превращение - первая реакция окисления в ходе гликолиза. Реакцию катализирует глицеральдегид-3-фосфатдегидрогеназа,которая является NAD-зависимым ферментом. Значение данной реакции заключается не только в том, что образуется восстановленный кофермент, окисление которого в дыхательной цепи сопряжено с синтезом АТФ, но также и в том, что свободная энергия окисления концентрируется в макроэргической связи продукта реакции. Глицеральдегид- 3 -фосфатдегидрогеназа содержит в активном центре остаток цистеина, сульфгидрильная группа которого принимает непосредственное участие в катализе. Окисление глицеральдегид-3-фосфата приводит к восстановлению NAD и образованию с участием Н3РО4 высокоэнергетической ангидридной связи в 1,3-бисфосфоглицерате в положении 1. В следующей реакции высокоэнергетический фосфат передаётся на АДФ с образованием АТФ. Фермент, катализирующий это превращение, назван по обратной реакции фосфоглицераткиназой (киназы называются по субстрату, находящемуся в уравнении реакции по одну сторону с АТФ).
Образование АТФ описанным способом не связано с дыхательной цепью, и его называют субстратным фосфорилированием АДФ. Образованный 3-фосфоглицерат уже не содержит макроэргической связи. В следующих реакциях происходят внутримолекулярные перестройки, смысл которых сводится к тому, что низкоэнергетический фосфоэфир переходит в соединение, содержащее высокоэнергетический фосфат. Внутримолекулярные преобразования заключаются в переносе фосфатного остатка из положения 3 в фосфоглицерате в положение 2. Затем от образовавшегося 2-фосфоглицерата отщепляется молекула воды при участии фермента енолазы. Название дегидратирующего фермента дано по обратной реакции. В результате реакции образуется замещённый енол - фосфоенолпируват. Образованный фосфоенолпируват - макроэргическое соединение, фосфатная группа которого переносится в следующей реакции на АДФ при участии пируваткиназы (фермент также назван по обратной реакции, в которой происходит фосфорилирование пирувата, хотя подобная реакция в таком виде не имеет места).
Превращение фосфоенолпирувата в пируват - необратимая реакция. Это вторая в ходе гликолиза реакция субстратного фосфорилирования. Образующаяся енольная форма пирувата затем неферментативно переходит в более термодинамически стабильную кетофор-му.
50.Распространение и физиологическое значение аэробного распада глюкозы. Использование глюкозы для синтеза жиров в печени и в жировой ткани.
Основное физиологическое назначение катаболизма глюкозы заключается в использовании энергии, освобождающейся в этом процессе для синтеза АТФ. Энергия, выделяющаяся в процессе полного распада глюкозы до СО2 и Н2О, составляет 2880 кДж/моль. Если эту величину сравнить с энергией гидролиза высокоэнергетических связей
- 38 моль АТФ (50 кДж на моль АТФ), то получим: 50×38 = 1900 кДж, что составляет 65% от всей энергии, выделяющейся при полном распаде глюкозы. Такова эффективность использования энергии распада глюкозы для синтеза АТФ. Необходимо учитывать, что реальная эффективность процесса может быть ниже. Точно оценить выход АТФ можно только при субстратном фосфорилировании, а соотношение между поступлением водорода в дыхательную цепь и синтезом АТФ является приблизительным. Аэробный распад глюкозы происходит во многих органах и тканях и служит основным, хотя и не единственным, источником энергии для жизнедеятельности. Некоторые ткани находятся в наибольшей зависимости от катаболизма глюкозы как источника энергии. Например, клетки мозга расходуют до 100 г глюкозы в сутки, окисляя её аэробным путём. Поэтому недостаточное снабжение мозга глюкозой или гипоксия проявляются симптомами, свидетельствующими о нарушении функций мозга (головокружения, судороги, потеря сознания). Анаэробный распад глюкозы происходит в мышцах, в первые минуты мышечной работы, в эритроцитах (в которых отсутствуют митохондрии), а также в разных органах в условиях ограниченного снабжении их кислородом, в том числе в клетках опухолей. Для метаболизма клеток опухолей характерно ускорение как аэробного, так и анаэробного гликолиза. Но преимущественный анаэробный гликолиз и увеличение синтеза лактата служит показателем повышенной скорости деления клеток при недостаточной обеспеченности их системой кровеносных сосудов. Кроме энергетической функции, процесс катаболизма глюкозы может выполнять и анаболические функции. Метаболиты гликолиза используются для синтеза новых соединений. Фруктозо-6-фосфат и глицеральдегид-3-фосфат участвуют в образовании рибозо-5-фосфата - структурного компонента нуклеотидов; 3-фосфоглицерат может включаться в синтез аминокислот, таких как серии, глицин, цистеин. В печени и жировой ткани ацетил-КоА, образующийся из пирувата, используется как субстрат при биосинтезе жирных кислот, холестерина, а дигидроксиацетонфосфат как субстрат для синтеза глицерол-3-фосфата .
Окислительный этап образования пентоз и неокислительный этап (путь возвращения пентоз в гексозы) составляют вместе циклический процесс. Такой процесс можно описать общим уравнением:
6 Глюкозо-6-фосфат + 12 NADP+ + 2 Н2О → 5 Глюкозо-6-фосфат + 12 NADPH +12 Н+ + 6 СO2.
Это означает, что из 6 молекул глюкозы образуются 6 молекул рибулозо-5-фосфат (пентозы) и 6 молекул СО2. Ферменты неокислительной фазы превращают 6 молекул рибулозо-5-фосфат в 5 молекул глюкозы (гексозы). При последовательном проведении этих реакций единственным полезным продуктом является NADPH, образующийся в окислительной фазе пентозофосфатного пути. Такой процесс называют пентозофосфатным циклом Протекание пентозофосфатного цикла позволяет клеткам продуцировать NADPH, необходимый для синтеза жиров, не накапливая пентозы. Энергия, выделяющаяся при распаде глюкозы, трансформируется в энергию высокоэнергетического донора водорода - NADPH. Гидрированный NADPH служит источником водорода для восстановительных синтезов, а энергия NADPH преобразуется и сохраняется во вновь синтезированных веществах, например жирных кислотах, высвобождается при их катаболизме и используется клетками.
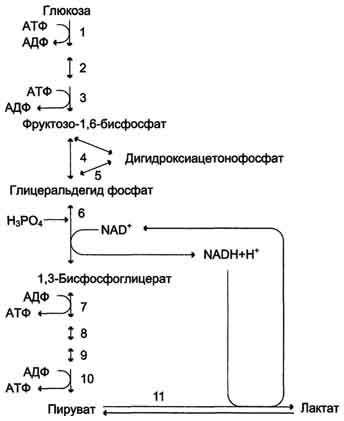
51 .Анаэробный распад глюкозы (анаэробный гликолиз). Гликолитическая оксиредукция, пируват как акцептор водорода. Субстратное фосфорилирование. Распространение и физиологическое значение этого пути распада глюкозы.
Анаэробным гликолизом называют процесс расщепления глюкозы с образованием в качестве конечного продукта лактата. Этот процесс протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи. АТФ образуется за счёт реакций субстратного фосфорилирования. Суммарное уравнение процесса:
С6Н1206 + 2 Н3Р04 + 2 АДФ = 2 С3Н6О3 + 2 АТФ + 2 Н2O.
Реакции анаэробного гликолизаПри анаэробном гликолизе в цитозоле протекают все 10 реакций, идентичных аэробному гликолизу. Лишь 11-я реакция, где происходит восстановление пирувата цитозольным NADH, является специфической для анаэробного гликолиза (рис. 7-41). Восстановление пирувата в лактат катализирует лактатдегидро-геназа (реакция обратимая, и фермент назван по обратной реакции). С помощью этой реакции обеспечивается регенерация NAD+ из NADH без участия митохондриальной дыхательной цепи в ситуациях, связанных с недостаточным снабжением клеток кислородом. Роль акцептора водорода от NADH (подобно кислороду в дыхательной цепи) выполняет пируват. Таким образом, значение реакции восстановления пирувата заключается не в образовании лактата, а в том, что данная цитозольная реакция обеспечивает регенерацию NAD+. К тому же лактат не является конечным продуктом метаболизма, удаляемым из организма. Это вещество выводится в кровь и утилизируется, превращаясь в печени в глюкозу, или при доступности кислорода превращается в пируват, который вступает в общий путь катаболизма, окисляясь до СО2 и Н2О.
52. Биосинтез глюкозы (глюконеогенез) из аминокислот, глицерина и молочной кислоты. Взаимосвязь гликолиза в мышцах и глюконеогенеза в печени (цикл Кори).
Глюконеогенез - процесс синтеза глюкозы из веществ неуглеводной природы. Его основной функцией является поддержание уровня глюкозы в крови в период длительного голодания и интенсивных физических нагрузок. Процесс протекает в основном в печени и менее интенсивно в корковом веществе почек, а также в слизистой оболочке кишечника. Эти ткани могут обеспечивать синтез 80-100 г глюкозы в сутки. На долю мозга при голодании приходится большая часть потребности организма в глюкозе. Это объясняется тем, что клетки мозга не способны, в отличие от других тканей, обеспечивать потребности в энергии за счёт окисления жирных кислот .Кроме мозга, в глюкозе нуждаются ткани и клетки, в которых аэробный путь распада невозможен или ограничен, например эритроциты (они лишены митохондрий), клетки сетчатки, мозгового слоя надпочечников и др. Первичные субстраты глюконеогенеза - лактат, аминокислоты и глицерол. Включение этих субстратов в глюконеогенез зависит от физиологического состояния организма.
- Лактат - продукт анаэробного гликолиза. Он образуется при любых состояниях организма в эритроцитах и работающих мышцах. Таким образом, лактат используется в глюконеогенезе постоянно.
- Глицерол высвобождается при гидролизе жиров в жировой ткани в период голодания или при длительной физической нагрузке.
- Аминокислоты образуются в результате распада мышечных белков и включаются в глюконеогенез при длительном голодании или продолжительной мышечной работе.
Большинство реакций глюконеогенеза протекает за счёт обратимых реакций гликолиза и катализируется теми же ферментами. Однако 3 реакции гликолиза термодинамически необратимы. На этих стадиях реакции глюконеогенеза протекают другими путями. Необходимо отметить, что гликолиз протекает в цитозоле, а часть реакций глюконеогенеза происходит в митохондриях.
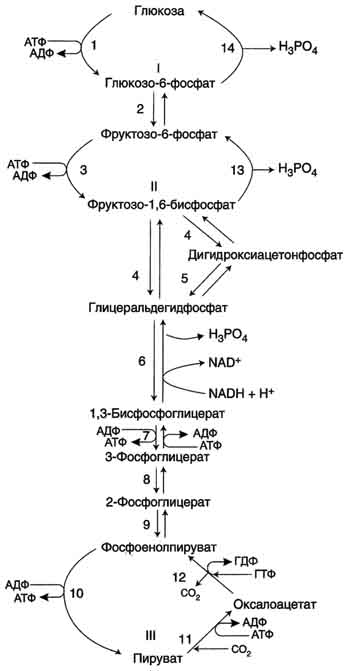
1. Образование фосфоенолпирувата из пирувата . Образование фосфоенолпирувата из пирувата происходит в ходе двух реакций первая из которых протекает в митохондриях. Пируват, образующийся из лактата или из некоторых аминокислот, транспортируется в матрикс митохондрий и там карбоксилируется с образованием оксалоацетата.
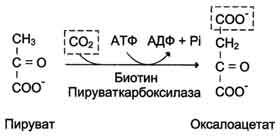
Пируват-карбоксилаза,катализирующая данную реакцию, - митохондриальный фермент, коферментом которого является биотин. Реакция протекает с использованием АТФ.
Дальнейшие превращения оксалоацетата протекают в цитозоле. Следовательно, на этом этапе должна существовать система транспорта оксалоацетата через митохондриальную мембрану, которая для него непроницаема. Оксалоацетат в митохондриальном матриксе восстанавливается с образованием малата при участии NADH (обратная реакция цитратного цикла).
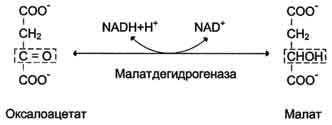
Образовавшийся малат затем проходит через митохондриальную мембрану с помощью специальных переносчиков. Кроме того, оксалоацетат способен транспортироваться из митохондрий в цитозоль в виде аспартата в ходе малат-аспартатного челночного механизма. В цитозоле малат вновь превращается в оксалоацетат в ходе реакции окисления с участием кофермента NAD+. Обе реакции: восстановление оксалоацетата и окисление малага катализируют малатдегидрогеназа, но в первом случае это митохондриальный фермент, а во втором - цитозольный. Образованный в цитозоле из ма-лата оксалоацетат затем превращается в фосфоенолпируват в ходе реакции, катализируемой фосфоенолпируваткарбоксикиназой - ГТФ-зависимым ферментом.
2. Образование глюкозы из лактата. Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NADH/NAD+ ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направлении, т.е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эту последовательность событий называют "глюкозо-лактатным циклом", или "циклом Кори".
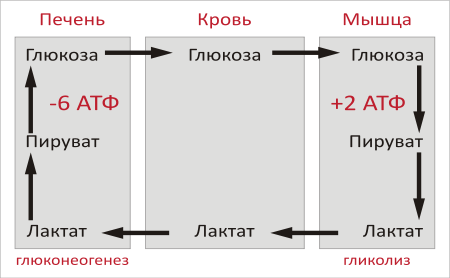
Цикл Кори выполняет 2 важнейшие функции: 1 - обеспечивает утилизацию лактата; 2 - предотвращает накопление лактата и, как следствие этого, опасное снижение рН (лактоацидоз). Часть пирувата, образованного из лактата, окисляется печенью до СО2 и Н2О. Энергия окисления может использоваться для синтеза АТФ, необходимого для реакций глюконеогенеза.
3. Образование глюкозы из аминокислот. Аминокислоты, которые при катаболизме превращаются в пируват или метаболиты цитратного цикла, могут рассматриваться как потенциальные предшественники глюкозы и гликогена и носят название гликогенных. Например, окса-лоацетат, образующийся из аспарагиновой кислоты, является промежуточным продуктом как цитратногр цикла, так и глюконеогенеза. Из всех аминокислот, поступающих в печень, примерно 30% приходится на долю аланина. Это объясняется тем, что при расщеплении мышечных белков образуются аминокислоты, многие из которых превращаются сразу в пируват или сначала в оксалоацетат, а затем в пируват. Последний превращается в аланин, приобретая аминогруппу от других аминокислот. Аланин из мышц переносится кровью в печень, где снова преобразуется в пируват, который частично окисляется и частично включается в глюкозонеогенез. Следовательно, существует следующая последовательность событий (глюкозо-аланиновый цикл): глюкоза в мышцах → пируват в мышцах → аланин в мышцах → аланин в печени → глюкоза в печени → глюкоза в мышцах. Весь цикл не приводит к увеличению количества глюкозы в мышцах, но он решает проблемы транспорта аминного азота из мышц в печень и предотвращает лактоацидоз.
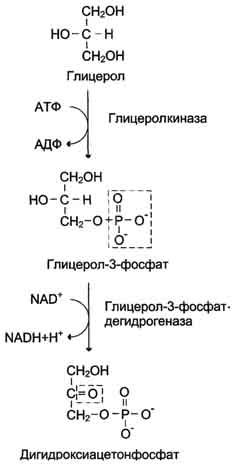
4. Образование глюкозы из глицерола. Глицерол образуется при гидролизе триацил-глицеролов, главным образом в жировой ткани. Использовать его могут только те ткани, в которых имеется фермент глицерол киназа, например печень, почки. Этот АТФ-зависимый фермент катализирует превращение глицерола в α-глицерофосфат (глицерол-3-фосфат). При включении глицерол-3-фосфата в глюконеогенез происходит его дегидрирование NAD-зависимой дегидрогеназой с образованием дигидроксиацетонфосфата, который далее превращается в глюкозу.
53. Представление о пентозофосфатном пути превращений глюкозы. Окислительные реакции (до стадии рибулозо-5-фосфата). Распространение и суммарные результаты этого пути (образование пентоз, НАДФН и энергетика)
Пентозофосфатный путь, называемый также гексомонофосфатным шунтом, служит альтернативным путём окисления глюкозо-6-фосфата. Пентозофосфатный путь состоит из 2 фаз (частей) - окислительной и неокислительной.
В окислительной фазе глюкозо-6-фосфат необратимо окисляется в пентозу - рибулозо-5-фосфат, и образуется восстановленный NADPH. В неокислительной фазе рибулозо-5-фосфат обратимо превращается в рибозо-5-фосфат и метаболиты гликолиза. Пентозофосфатный путь обеспечивает клетки рибозой для синтеза пуриновых и пиримидиновых нуклеотидов и гидрированным коферментом NADPH, который используется в восстановительных процессах. Суммарное уравнение пентозофосфатного пути выражается следующим образом:
3 Глюкозо-6-фосфат + 6 NADP+ → 3 СО2 + 6 (NADPH + Н+) + 2 Фруктозо-6-фосфат + Глицеральдегид- 3 -фосфат.
Ферменты пентозофосфатного пути, так же, как и ферменты гликолиза, локализованы в цитозоле. Наиболее активно пентозофосфатный путь протекает в жировой ткани, печени, коре надпочечников, эритроцитах, молочной железе в период лактации, семенниках.
В окислительной части пентозофосфатного пути глюкозо-6-фосфат подвергается окислительному декарбоксилированию, в результате которого образуются пентозы. Этот этап включает 2 реакции дегидрирования.
Первая реакция дегидрирования - превращение глюкозо-6-фосфата в глюконолактон-6-фосфат - катализируется NАDР+-зависимой глюкозо-6-фосфатдегидрогеназой и сопровождается окислением альдегидной группы у первого атома углерода и образованием одной молекулы восстановленного кофермента NADPH. Далее глюконолактон-6-фосфат быстро превращается в 6-фосфоглюконат при участии фермента глюконолактонгидратазы. Фермент 6-фосфоглюконатдегидрогеназа катализирует вторую реакцию дегидрирования окислительной части, в ходе которой происходит также и декарбоксилирование. При этом углеродная цепь укорачивается на один атом углерода, образуется рибулозо-5-фосфат и вторая молекула гидрированного NADPH. Восстановленный NADPH ингибирует первый фермент окислительного этапа пентозофосфатного пути - глюкозо-6-фосфатдегидрогеназу. Превращение NADPH в окисленное состояние NADP+ приводит к ослаблению ингибирования фермента. При этом скорость соответствующей реакции возрастает, и образуется большее количество NADPH.
Суммарное уравнение окислительного этапа пентозофосфатного пути можно представить в виде:
Глюкозо-6-фосфат + 2 NADP+ + Н2О → Рибулозо-5-фосфат + 2 NADPH + Н+ + СО2.
Реакции окислительного этапа служат основным источником NADPH в клетках. Гидрированные коферменты снабжают водородом биосинтетические процессы, окислительно-восстановительные реакции, включающие защиту клеток от активных форм кислорода.
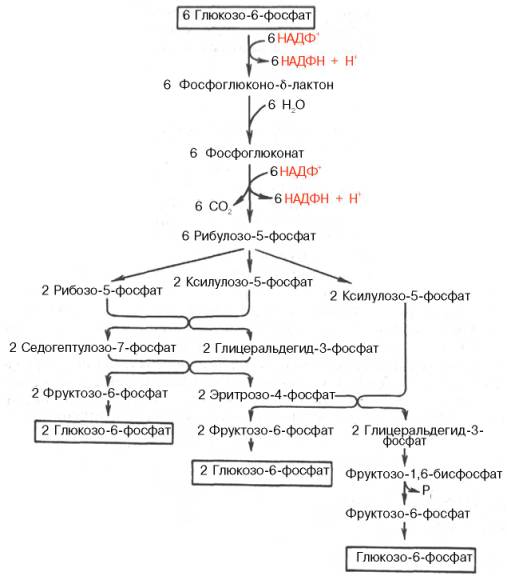
Окислительный этап образования пентоз и неокислительный этап (путь возвращения пентоз в гексозы) составляют вместе циклический процесс. Такой процесс можно описать общим уравнением:
6 Глюкозо-6-фосфат + 12 NADP+ + 2 Н2О → 5 Глюкозо-6-фосфат + 12 NADPH +12 Н+ + 6 СO2.
Это означает, что из 6 молекул глюкозы образуются 6 молекул рибулозо-5-фосфат (пентозы) и 6 молекул СО2. Ферменты неокислительной фазы превращают 6 молекул рибулозо-5-фосфат в 5 молекул глюкозы (гексозы). При последовательном проведении этих реакций единственным полезным продуктом является NADPH, образующийся в окислительной фазе пентозофосфатного пути. Такой процесс называют пентозофосфатным циклом. Протекание пентозофосфатного цикла позволяет клеткам продуцировать NADPH, необходимый для синтеза жиров, не накапливая пентозы.
Энергия, выделяющаяся при распаде глюкозы, трансформируется в энергию высокоэнергетического донора водорода - NADPH. Гидрированный NADPH служит источником водорода для восстановительных синтезов, а энергия NADPH преобразуется и сохраняется во вновь синтезированных веществах, например жирных кислотах, высвобождается при их катаболизме и используется клетками.
54. Свойства и распространение гликогена как резервного полисахарида. Биосинтез гликогена. Мобилизация гликогена.
Гликоген - разветвлённый гомополимер глюкозы, в котором остатки глюкозы соединены в линейных участках α-1,4-гликозидной связью. В точках ветвления мономеры соединены α-1,6-гликозидными связями. Эти связи образуются примерно с каждым десятым остатком глюкозы. Следовательно, точки ветвления в гликогене встречаются примерно через каждые десять остатков глюкозы. Так возникает древообразная структура с молекулярной массой >107Д, что соответствует приблизительно 50 000 остатков глюкозы. Таким образом, в молекуле гликогена имеется только одна свободная аномерная ОН-группа и, следовательно, только один восстанавливающий (редуцирующий) конец. В клетках животных гликоген - основной резервный полисахарид. При полимеризации глюкозы снижается растворимость образующейся молекулы гликогена и, следовательно, её влияние на осмотическое давление в клетке. Это обстоятельство объясняет, почему в клетке депонируется гликоген, а не свободная глюкоза. Гликоген хранится в цитозоле клетки в форме гранул диаметром 10-40 нм. С гранулами связаны и некоторые ферменты, участвующие в метаболизме гликогена, что облегчает их взаимодействие с субстратом. Разветвлённая структура гликогена обусловливает большое количество концевых мономеров, что способствует работе ферментов, отщепляющих или присоединяющих мономеры при распаде или синтезе гликогена, так как эти ферменты могут одновременно работать на нескольких ветвях молекулы. Гликоген депонируется главным образом в печени и скелетных мышцах. Распад гликогена печени служит в основном для поддержания уровня глюкозы в крови в постабсорбтивном периоде. Поэтому содержание гликогена в печени изменяется в зависимости от ритма питания. При длительном голодании оно снижается почти до нуля. Гликоген мышц служит резервом глюкозы - источника энергии при мышечном сокращении. Мышечный гликоген не используется для поддержания уровня глюкозы в крови. Как уже упоминалось ранее, в клетках мышц нет фермента глюкозо-6-фосфатазы, и образование свободной глюкозы невозможно. Расход гликогена в мышцах зависит в основном от физической нагрузки.
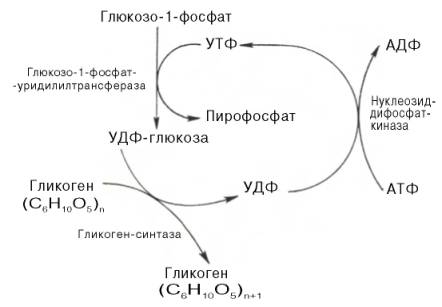
Гликоген синтезируется в период пищеварения (через 1-2 ч после приёма углеводной пищи). Следует отметить, что синтез гликогена из глюкозы как и любой анаболический процесс, является эндергоническим, т.е. требующим затрат энергии. Глюкоза, поступающая в клетку, фосфорилируется при участии АТФ (реакция 1). Затем глюкозо-6-фосфат в ходе обратимой реакции превращается в глюкозо-1 -фосфат (реакция 2) под действием фермента фосфоглюкомутазы. Глюкозо-1-фосфат по термодинамическому состоянию мог бы служить субстратом для синтеза гликогена. Но в силу обратимости реакции глюкозо-6-фосфат ↔ глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинамически необратимым, необходима дополнительная стадия образования уридинди-фосфатглюкозы из УТФ и глюкозо-1-фосфата (реакция 3). Фермент, катализирующий эту реакцию, назван по обратной реакции: УДФ-глюкопирофосфорилаза.Однако в клетке обратная реакция не протекает, потому что образовавшийся в ходе прямой реакции пирофосфат очень быстро расщепляется пирофосфатазой на 2 молекулы фосфата.
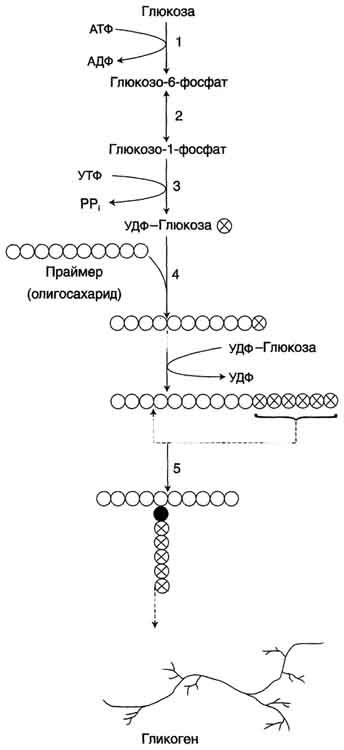
Образованная УДФ-глюкозадалее используется как донор остатка глюкозы при синтезе гликогена (реакция 4). Эту реакцию катализирует фермент гликогенсинтаза (глюкозилтрансфераза).Поскольку в данной реакции не используется АТФ, фермент называют синтазой, а не синтетазой.
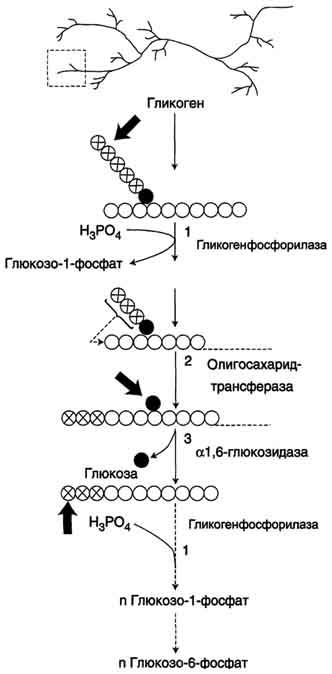
Распад гликогена или его мобилизация происходят в ответ на повышение потребности организма в глюкозе. Гликоген печени распадается в основном в интервалах между приёмами пищи, кроме того, этот процесс в печени и мышцах ускоряется во время физической работы. Распад гликогена происходит путём последовательного отщепления остатков глюкозы в виде глюкозо-1-фосфата. Гликозидная связь расщепляется с использованием неорганического фосфата, поэтому процесс называется фосфоролизом, а фермент гликогенфосфорилазой. Так же как и синтез, расщепление гликогена начинается с нередуцирующего конца полисахаридной цепи. При этом наличие разветвлённой структуры гликогена облегчает быстрое высвобождение глюкозных остатков, так как чем больше концов имеет молекула гликогена, тем больше молекул гликогенфосфорилазы могут действовать одновременно. Гликогенфосфорилазарасщепляет только α-1,4-гликозидные связи (реакция 1). Последовательное отщепление глюкозных остатков прекращается, когда до точки ветвления остаётся 4 мономера. Подобная особенность в действии гликогенфосфорилазы обусловлена размером и строением её активного центра. Дальнейший распад гликогена требует участия двух других ферментов. Сначала три оставшихся до точки ветвлении глюкозных остатка переносятся при участии олигосахаридтрансферазы (реакция 2) на нередуцирующий конец соседней цепи, удлиняя её и таким образом создавая условия для действия фосфорилазы. Оставшийся в точке ветвления глюкозный остаток гидролитически отщепляется с помощью α-1,6-глюкозидазы в виде свободной глюкозы (реакция 3), после чего неразветвлённый участок гликогена может вновь атаковаться фосфорилазой. Считают, что перенос трёх остатков глюкозы и удаление мономера из точки ветвления (реакции 2 и 3) катализирует один и тот же фермент, который обладает двумя разными ферментативными активностями - трансферазной и гликозидазной. Его называют "деветвящим" ферментом Продукт действия гликогенфосфорилазы - глюкозо-1-фосфат - затем изомеризуется в глюкозо-6-фосфат фосфоглюкомутазой. Далее глюкозо-6-фосфат включается в процесс катаболизма или другие метаболические пути. В печени (но не в мышцах) глюкозо-6-фосфат может гидролизоваться с образованием глюкозы, которая выделяется в кровь. Эту реакцию катализирует фермент глюкозо-6-фосфатаза. Реакция протекает в просвете ЭР, куда с помощью специального белка транспортируется глюкозо-6-фосфат. Фермент локализован на мембране ЭР таким образом, что его активный центр обращён в просвет ЭР. Продукты гидролиза (глюкоза и неорганический фосфат) возвращаются в цитоплазму также с помощью транспортных систем.
55. Особенности обмена глюкозы в разных органах и клетках: эритроциты, мозг, мышцы, жировая ткань, печень.
Метаболизм глюкозы в эритроцитах. Эритроциты лишены митохондрий, поэтому в качестве энергетического материала они могут использовать только глюкозу. В эритроцитах катаболизм глюкозы обеспечивает сохранение структуры и функции гемоглобина, целостность мембран и образование энергии для работы ионных насосов. Глюкоза поступает в эритроциты путём облегчённой диффузии с помощью ГЛЮТ-2. Около 90% поступающей глюкозы используется в анаэробном гликолизе, а остальные 10% - в пентозофосфатном пути. Конечный продукт анаэробного гликолиза лактат выходит в плазму крови и используется в других клетках, прежде всего гепатоцитах. АТФ, образующийся в анаэробном гликолизе, обеспечивает работу Nа+, К+-АТФ-азы и поддержание самого гликолиза, требующего затраты АТФ в гексокиназной и фосфофруктокиназной реакциях. Важная особенность анаэробного гликолиза в эритроцитах по сравнению с другими клетками - присутствие в них фермента бисфосфоглицератмутазы. Бисфосфоглицератмутаза катализирует образование 2,3-бисфосфоглицерата из 1,3-бисфосфоглицерата. Образующийся только в эритроцитах 2,3-бисфосфоглицерат служит важным аллостерическим регулятором связывания кислорода гемоглобином. Глюкоза в эритроцитах используется и в пентозофосфатном пути, окислительный этап которого обеспечивает образование кофермента NADPH, необходимого для восстановления глу-татиона.
Метаболизм глюкозы в печени. Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Это достигается регуляцией между синтезом и распадом гликогена, депонируемого в печени. В печени синтез гликогена и его регуляция в основном аналогичны тем процессам, которые протекают в других органах и тканях, в частности в мышечной ткани. Синтез гликогена из глюкозы обеспечивает в норме временный резерв углеводов, необходимый для поддержания концентрации глюкозы в крови в тех случаях, если ее содержание значительно уменьшается (например, у человека это происходит при недостаточном поступлении углеводов с пищей или в период ночного «голодания»). Необходимо подчеркнуть важную роль фермента глюкокиназы в процессе утилизации глюкозы печенью. Глюкокиназа, подобногексокиназе, катализирует фосфорилирование глюкозы с образованием глюкозо-6-фосфата, при этом активность глюкокиназы в печенипочти в 10 раз превышает активность гексокиназы. Важное различие между этими двумя ферментами заключается в том, что глюкокиназа в противоположность гексокиназе имеет высокое значение КМ для глюкозы и не ингибируется глюкозо-6-фосфатом. Считают, что основная роль печени – расщепление глюкозы – сводится прежде всего к запасанию метаболитов-предшественников, необходимых для биосинтеза жирных кислот и глицерина, и в меньшей степени к окислению ее до СО2 и Н2О. Синтезированные впечени триглицериды в норме выделяются в кровь в составе липопротеинов и транспортируются в жировую ткань для более «постоянного» хранения. В реакциях пентозофосфатного пути в печени образуется НАДФН, используемый для восстановительных реакций в процессах синтезажирных кислот, холестерина и других стероидов. Кроме того, при этом образуются пентозофосфаты, необходимые для синтезануклеиновых кислот. Наряду с утилизацией глюкозы в печени происходит и ее образование. Непосредственным источником глюкозы в печени служитгликоген. Распад гликогена в печени происходит в основном фосфоролитическим путем. В регуляции скорости гликогенолиза в печенибольшое значение имеет система циклических нуклеотидов. Кроме того, глюкоза в печени образуется также в процессе глюконеогенеза.
Метаболизм глюкозы в мозгу. Основным субстратом дыхания мозговой ткани является глюкоза. В 1 мин 100 г ткани мозга потребляют в среднем 5 мг глюкозы. Подсчитано, что более 90% утилизируемой глюкозы в ткани мозга окисляется до СО2 и Н2О при участии цикла трикарбоновых кислот. В физиологических условиях роль пентозофосфатного пути окисления глюкозы в мозговой ткани невелика, однако этот путь окисленияглюкозы присущ всем клеткам головного мозга. Образующаяся в процессе пентозофосфатного цикла восстановленная форма НАДФ (НАДФН) используется для синтеза жирных кислот и стероидов. Между глюкозой и гликогеном мозговой ткани имеется тесная связь, выражающаяся в том, что при недостаточном поступлении глюкозыиз крови гликоген головного мозга является источником глюкозы, а глюкоза при ее избытке – исходным материалом для синтеза гликогена. Распад гликогена в мозговой ткани происходит путем фосфоролиза с участием системы цАМФ. Однако в целом использование гликогена в мозге по сравнению с глюкозой не играет существенной роли в энергетическом отношении, так как содержание гликогена в головном мозге невелико. Наряду с аэробным метаболизмом углеводов мозговая ткань способна к довольно интенсивному анаэробному гликолизу. Значение этого явления пока недостаточно ясно, ибо гликолиз как источник энергии ни в коей мере не может сравниться по эффективности с тканевым дыханием в головном мозге.
Метаболизм глюкозы в мышцах. При работе умеренной интенсивности мышца может покрывать свои энергетические затраты за счет аэробного метаболизма. Однако при больших нагрузках, когда возможность снабжения кислородом отстает от потребности в нем, мышца вынуждена использовать гликолитический путь снабжения энергией. При интенсивной мышечной работе скорость расщепления гликогена или глюкозы с образованием молочной кислоты увеличивается в сотни раз. Соответственно содержание молочной кислоты в мышечной ткани может повышаться до 1,0–1,2 г/кг и более. С током крови значительное количество молочной кислоты поступает в печень, где ресинтезируется в глюкозу и гликоген (глюконеогенез) за счет энергии окислительных процессов.
Метаболизм глюкозы в жировой ткани. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот.
56. Представление о строении и функциях углеводной части гликолипидов и гликопротеинов. Сиаловые кислоты
Гликопротеины– сложные белки, содержащие, помимо простого белка или пептида, группу гетероолигосахаридов. В настоящее время их принято называть гликоконъюгатами. В состав гликоконъюгата входит углеводный компонент (гликановая фракция), ковалентно связанный с неуглеводной частью (агликановая фракция), представленной белком, пептидом, аминокислотой или липидом. Химический состав гликопротеинов более или менее установлен, структура определена только у ряда из них. К полипептидуприсоединяются гетероолигосахаридные цепи, содержащие от 2 до 10, реже 15 мономерных остатков гексоз (галактоза и манноза, режеглюкоза), пентоз (ксилоза, арабиноза) и конечный углевод, чаще всего представленный N-ацетилга-лактозамином, L-фукозой или сиаловой кислотой; в отличие от про-теогликанов гликопротеины не содержат уроновых кислот и серной кислоты. Типы связей между углеводными компонентами и белками определены только у ряда гликопротеинов, аминокислотный состав и структура которых известны (иммуноглобулины, гормоны); они включают О-гликозидные связи (с ОН-группами серина, треонина и оксилизина), N-гликозидные связи (с амидными группами аспарагина, реже глутамина или ω-NH2-группами лизина и аргинина) и эфирные гликозидные связи со свободными СООН-группами глутаминовой и аспарагиновой кислот. Углеводные компоненты соединены ковалентно с азотом аспарагина молекулы белка.
Гликолипиды —сложные липиды, образующиеся в результате соединения липидов с углеводами. У гликолипидов имеются полярные «головы» (углевод) и неполярные «хвосты» (остатки жирных кислот). Благодаря данному свойству, вместе с фосфолипидами, гликолипиды входят в состав клеточных мембран. Гликолипиды широко представлены в тканях, особенно в нервной ткани, в частности в ткани мозга. Они локализованы преимущественно на наружной поверхности плазматической мембраны, где их углеводые компоненты входят в число других углеводов клеточной поверхности.
Сиа́ловые кисло́ты - ациальные производные нейраминовой кислоты, присутствуют во всех тканях и жидкостях организма животных и человека и у некоторых микроорганизмов. У человека в норме наибольшее количество Сиаловые кислоты обнаруживается в слюнных железах, в секретах различных слизистых оболочек, а также в сыворотке крови, где их содержание резко повышается при ряде заболеваний. Сиаловые кислоты являются полифункциональными соединениями с сильными кислотными свойствами. Как правило, в свободном виде в норме они не встречаются, а входят в состав различных углеводсодержащих веществ, таких как гликопротеины, гликолипиды (ганглиозиды), олигосахариды. Занимая в молекулах этих веществ концевое положение, сиаловые кислоты оказывают значительное влияние на их физико-химические свойства и биологическую активность. Определяя отрицательный заряд молекул гликопротеинов, сиаловые кислоты обусловливают вытянутую форму их молекул и как следствие высокую вязкость содержащих эти гликопротеины секретов слизистых оболочек дыхательного, кишечного и полового трактов. Это обеспечивает защиту слизистых оболочек от механических и химических повреждений. Наличие сиаловых кислот в составе белков крови (церулоплазмина, кислого α1-гликопротеина и др.) и некоторых гормонов (хорионического гонадотропина, фолликулостимулирующего и лютеинизирующего гормонов) определяет длительность циркуляции этих соединений в кровотоке. После отщепления сиаловой кислоты, когда концевым сахаром в молекулах гликопротеинов становится галактоза, эти белки поглощаются клетками печени. Именно этим объясняется потеря гормонами биологической активности. Длительность циркуляции в кровотоке некоторых клеток крови (эритроцитов, лимфоцитов) также зависит от наличия или отсутствия сиаловых кислот на их поверхности. Процесс старения эритроцитов связан с уменьшением количества сиаловых кислот в их оболочке. Находясь в составе углеводной части гликопротеинов, сиаловые кислоты маскируют остатки сахаров, являющихся антигенными детерминантами и таким образом, играют важную роль в иммунных реакциях, снижая иммуногенные свойства нормальных и опухолевых клеток. Установлено, что сиаловые кислоты являются компонентом клеточных рецепторов, специфичных для вирусов гриппа.
57. Наследственные нарушения обмена моносахаридов и дисахаридов: галактоземия, непереносимость фруктозы и дисахаридов. Гликогенозы и агликогенозы
Нарушения метаболизма фруктозы
| Неактивный фермент | Блокируемая реакция | Локализация фермента | Клинические проявления и лабораторные данные |
| Фруктокиназа | Фруктоза + АТФ → Фруктозе-1-фосфат + АДФ | Печень Почки Энтероциты | Фруктоземия, фруктозурия |
| Фруктозе-1-фосфатальдолаза | Фруктозе-1-фосфат → Дигидроксиацетон-3 -фосфат + Глицеральдегид | Печень | Рвота, боли в животе, диарея, гипогликемия, Гипофосфатемия, фруктоземия, гиперурикемия, хроническая недостаточность функций печени, почек. |
Недостаточность фруктокиназы клинически не проявляется. Фруктоза накапливается в крови и выделяется с мочой, где её можно обнаружить лабораторными методами. Очень важно не перепутать эту безвредную аномалию с сахарным диабетом. Данное заболевание известно как доброкачественная эссенциальная фруктозурия и встречается с частотой 1:130 000.
Наследственная непереносимость фруктозы,возникающая при генетически обусловленном дефекте фруктозо-1-фосфатальдолазы, не проявляется, пока ребёнок питается грудным молоком, т.е. пока пища не содержит фруктозы. Симптомы возникают, когда в рацион добавляют фрукты, соки, сахарозу. Рвота, боли в животе, диарея, гипогликемия и даже кома и судороги возникают через 30 мин после приёма пищи, содержащей фруктозу. У маленьких детей и подростков, продолжающих принимать фруктозу, развиваются хронические нарушения функций печени и почек. Непереносимость фруктозы - достаточно частая аутосомно-рецессивная форма патологии.
Дефект альдолазы фруктозе-1-фосфата сопровождается накоплением фруктозе-1-фосфата, который ингибирует активность фосфоглюко-мутазы, превращающей глюкозо-1-фосфат в глюкозо-6-фосфат и обеспечивающей включение продукта гликогенфосфорилазной реакции в метаболизм. Поэтому происходит торможение распада гликогена на стадии образования глюкозо-1 -фосфата, в результате чего развивается гипогликемия. Как следствие, ускоряется мобилизация липидов и окисление жирных кислот. Следствием ускорения окисления жирных кислот и синтеза кетоновых тел, замещающих энергетическую функцию глюкозы, может быть метаболический ацидоз, так как кетоновые тела являются кислотами и при высоких концентрациях снижают рН крови. Результатом торможения гликогенолиза и гликолиза является снижение синтеза АТФ. Кроме того, накопление фосфорилированной фруктозы ведёт к нарушению обмена неорганического фосфата и гипофосфатемии. Для пополнения внутриклеточного фосфата ускоряется распад адениловых нуклеотидов. Продукты распада этих нуклеотидов включаются в катаболизм, проходя стадии образования гипоксантина, ксантина и, наконец, мочевой кислоты. Повышение количества мочевой кислоты и снижение экскреции уратов в условиях метаболического ацидоза проявляются в виде гиперурикемии. Следствием гиперурикемии может быть подагра даже в молодом возрасте
| Глицеральдегид -3 –фосфат |
| АТФ |
| АДФ |
| Диоксиацетонфосфат |
| Фруктоза |
| Фруктозо-1-фосфат |
| Глицеральдегид |
| Фруктозо-1,6 – дифосфат |
| Глюкоза |
| Альдолаза(2) |
| Киназа |
| АТФ |
| АДФ |
| Фруктокиназа |
| Альдолаза(1) |
АТФ
АДФ
Дата добавления: 2016-12-26; просмотров: 2491;
