Способы получения алкенов
1. CH3—CH3 →Ni, t → CH2=CH2 + H2 (дегидрирование алканов)
2. С2Н5OH →H,SO4, 170 °C→ CH2=CH2 + Н2O (дегидратация спиртов)
3. (дегидрогалогенирование алкилгалогенидов по правилу Зайцева)
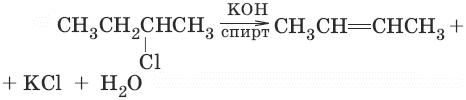
4. CH2Cl—CH2Cl + Zn → ZnCl2 + CH2=CH2 (дегалогенирование дигалогенопроизводных)
5. HC≡CH + Н2 →Ni, t → CH2=CH2 (восстановление алкинов)
Химические свойства алкенов
Для алкенов наиболее характерны реакции присоединения, они легко окисляются и полимеризуются.
1. CH2=CH2 + Br2 → CH2Br—CH2Br
(присоединение галогенов, качественная реакция)
2. (присоединение галогеноводородов по правилу Марковникова)
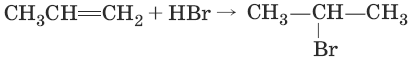
3. CH2=CH2 + Н2 →Ni, t → CH3—CH3 (гидрирование)
4. CH2=CH2 + Н2O →H+ → CH3CH2OH (гидратация)
5. ЗCH2=CH2 + 2КMnO4 + 4Н2O → ЗCH2OH—CH2OH + 2MnO2↓ + 2KOH (мягкое окисление, качественная реакция)
6. CH2=CH—CH2—CH3 + КMnO4 →H+ → CO2 + С2Н5COOH (жесткое окисление)
7. CH2=CH—CH2—CH3 + O3 → Н2С=O + CH3CH2CH=O формальдегид+пропаналь → (озонолиз)
8. С2Н4 + 3O2 → 2CO2 + 2Н2O (реакция горения)
9. (полимеризация)
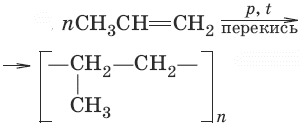
10. CH3—CH=CH2 + HBr →перекись → CH3—CH2—CH2Br (присоединение бро-моводорода против правила Марковникова)
11. (реакция замещения в α-положение)
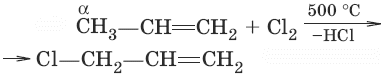
Алкины
Алкины (ацетиленовые углеводороды) – ненасыщенные углеводороды, имеющие в своем составе тройную С≡С связь. Общая формула алкинов с одной тройной связью СnН2n-2. Простейший представитель ряда алкинов CH≡CH имеет тривиальное название ацетилен. По систематической номенклатуре названия ацетиленовых углеводородов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса –ан на-ин : этан (CH3—CH3) – этин (CH≡CH) и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя тройную связь. Нумерацию углеродных атомов начинают с ближнего к тройной связи конца цепи.
В образовании тройной связи участвуют атомы углерода в sp -гибридизованном состоянии. Каждый из них имеет по две sp- гибридных орбитали, направленных друг к другу под углом 180°, и две негибридных p -орбитали, расположенных под углом 90° по отношению друг к другу и к sp -гибридным орбиталям.
Пространственное строение ацетилена:
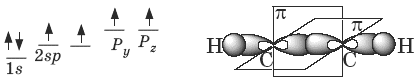
Виды изомерии: 1) изомерия положения тройной связи; 2) изомерия углеродного скелета; 3) межклассовая изомерия с алкадиенами и циклоалкенами.
Дата добавления: 2016-04-23; просмотров: 1319;
