Способы получения циклоалканов
1. Получение из дигалогенопроизводных углеводородов
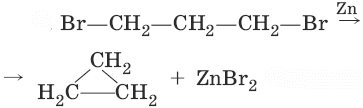
2. Получение из ароматичесих углеводородов
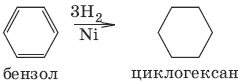
Химические свойства циклоалканов
Химические свойства циклоалканов зависят от размера цикла, определяющего его устойчивость. Трех– и четырехчленные циклы (малые циклы), являясь насыщенными, резко отличаются от всех остальных предельных углеводородов. Циклопропан, циклобутан вступают в реакции присоединения. Для циклоалканов (С5 и выше) вследствие их устойчивости характерны реакции, в которых сохраняется циклическая структура, т. е. реакции замещения.
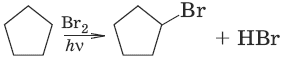
1. Действие галогенов
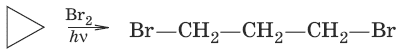

2. Действие галогеноводородов
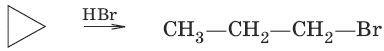
С циклоалканами, содержащими пять и более атомов углерода в цикле, галогеново-дороды не взаимодействуют.
3.
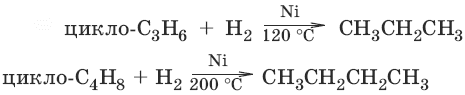
4. Дегидрирование
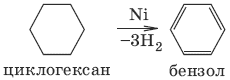
Алкены
Алкены (непредельные углеводороды, этиленовые углеводороды, олефины) – непредельные алифатические углеводороды, молекулы которых содержат двойную связь. Общая формула ряда алкенов СnН2n.
По систематической номенклатуре названия алкенов производят от названий соответствующих алканов (с тем же числом атомов углерода) путем замены суффикса– ан на– ен : этан (CH3—CH3) – этен (CH2=CH2) и т. д. Главная цепь выбирается таким образом, чтобы она обязательно включала в себя двойную связь. Нумерацию углеродных атомов начинают с ближнего к двойной связи конца цепи.
В молекуле алкена ненасыщенные атомы углерода находятся в sp2 -гибридизации, а двойная связь между ними образована σ– и π-связью. sp2 -Гибридные орбитали направлены друг к другу под углом 120°, и одна негибридизованная 2р -орбиталь, расположена под углом 90° к плоскости гибридных атомных орбиталей.
Пространственное строение этилена:
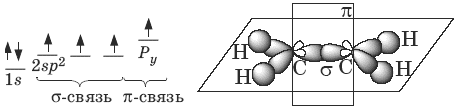
Длина связи С=С 0,134 нм, энергия связи С=С Ес=с = 611 кДж/моль, энергия π-связи Еπ = 260 кДж/моль.
Виды изомерии: а) изомерия цепи; б) изомерия положения двойной связи; в) Z, Е (cis, trans ) – изомерия, вид пространственной изомерии.
Дата добавления: 2016-04-23; просмотров: 2179;
