Получение циклоалканов.
1. Каталитическое гидрирование ароматических углеводородов:
С6Н6 + 3Н2 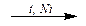 C6H12.
C6H12.
2. Дегалогенирование дигалогеноалканов с помощью цинка, магния или натрия (в основном для получения малых циклов):
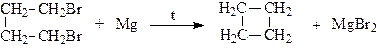
АЛКЕНЫ
Фрагмент молекулы, содержащий двойную связь, плоский, углы между связями равны 120°С. Если каждый атом углерода при двойной связи имеет разные заместители, то для соединения существует геометрическая изомерия. Кроме того, для алкенов существует изомерия углеродного скелета и изомерия положения кратной связи.
Физические свойства. Алкены, содержащие от двух до четырех атомов углерода – газы, остальные – жидкости.
Химические свойства. Прочность p-связи значительно меньше прочности s-связи, поэтому кратная связь в молекулах алкенов легко разрывается и гибридизация атомов углерода изменяется от sp2- до sp3-. Основными видами химических реакций алкенов являются реакции электрофильного присоединения (гетеролитический механизм разрыва связей), полимеризации и окисления по двойной связи.
Реакции присоединения(по электрофильному механизму, АЕ)
1. Галогенирование: CH2=CH2 + Br2 ® CH2Br–CH2Br
(обесцвечивание бромной воды – водного раствора брома – является качественной реакцией соединений с двойными и тройными связями).
При повышении температуры выше 500оС при галогенировании алкенов идут реакции замещения, а не присоединения:
 СН3-СН=СН2 + Br2 540°C СН3-СBr=СН2 + HBr
СН3-СН=СН2 + Br2 540°C СН3-СBr=СН2 + HBr
2. Гидрирование и дегидрирование:
CH2=CH2 + H2 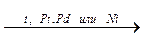 CH3–CH3
CH3–CH3
(переход алкенов в алканы);
CH2=CH–СН2–СН3 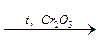 CH2=CH–СН=СН2
CH2=CH–СН=СН2
(переход в алкадиены)
3. Гидрогалогенирование:
СH3–CH=CH2 + HBr ® CH3–CHBr–CH3
(реакция идет по правилу Марковникова: водород присоединяется по двойной связи к наиболее гидрированному атому углерода).
В присутствии пероксида водорода и других пероксидных соединений механизм реакции меняется на радикальный и реакция гидрогалогенирования идет против правила Марковникова (эффект Хараша):
 СН3-СН=СН2 + HCl Н2О2 СН3-СН2-СН2Cl (АR)
СН3-СН=СН2 + HCl Н2О2 СН3-СН2-СН2Cl (АR)
4. Гидратация:
СH3–CH=CH2+H2О 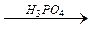 CH3–CH(ОН)–CH3
CH3–CH(ОН)–CH3
(получение спиртов, реакция идет по правилу Марковникова).
5. Поглощение алкенов серной кислотой:
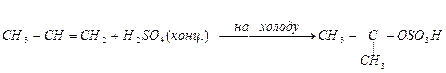
Реакции окисления
СnH2n + 1,5nO2 ® nCO2 + nH2O (горение);
3CH2=CH2 + 2KMnO4 + 4H2O ® 3HO–CH2–CH2–OH + 2MnO2¯ + 2KOH
(мягкое окисление перманганатом калия в нейтральной среде);
5СH3–CH=CH–CH3 + 8KMnO4 + 12H2SO4 ®
® 10CH3COOH + 8MnSO4 + 4K2SO4 + 12H2O;
5 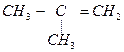 + 8KMnO4 + 12H2SO4 ®
+ 8KMnO4 + 12H2SO4 ®
® 5 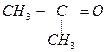 + 5CO2 + 8MnSO4 + 4K2SO4 + 17H2O
+ 5CO2 + 8MnSO4 + 4K2SO4 + 17H2O
(жесткое окисление перманганатом калия в кислой среде).
Реакции полимеризации

 n(CH3–СH=CH2)
n(CH3–СH=CH2) 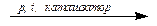
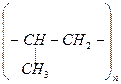
Полимер – макромолекула, состоящая из большого числа повторяющихся звеньев – мономеров. Число повторений мономеров в цепи (n) носит название «степень полимеризации»). В процессе полимеризации обычно получают смесь макромолекул с различными степенями полимеризации, поэтому полимеры характеризуются не фиксированной температурой плавления, а плавятся в интервале температур.
Реакции полимеризации связаны с разрывом двойных связей в молекулах мономеров.
Получение алкенов.
1. Крекинг алканов: С8H18 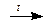 C4H10 + C4H8.
C4H10 + C4H8.
2. Дегидрирование алканов:
CH3–CH3 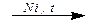 CH2=CH2 + H2.
CH2=CH2 + H2.
3. Дегидратация спиртов (водород уходит от наименее гидрированного атома углерода – правило Зайцева):
СН3–СН(ОН)–СН2–СН3 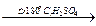 СН3–СН=СН–СН3 + Н2О.
СН3–СН=СН–СН3 + Н2О.
4. Дегидрогалогенирование моногалогеналканов:
CH3–CH3Cl + KOH 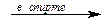 CH2=CH2 + KCl + H2O.
CH2=CH2 + KCl + H2O.
5. Дегалогенирование дигалогеналканов:
CH2Br–CHBr–CH3 + Mg (или Zn) 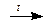 CH2=CH–CH3 + MgBr2 (или ZnBr2).
CH2=CH–CH3 + MgBr2 (или ZnBr2).
Алкадиены
Алкадиены характеризуются наличием двух двойных связей. В зависимости от их взаимного расположения они делятся на следующие типы:
а). Аллены (1,2-диены), соединения общей формулы RRC=C=CR"R", содержащие рядом стоящие (кумулированные) двойные связи. Электронное строение кумулированных двойных связей в алленах предусматривает sp2-электронное состояние для обоих крайних атомов углерода. Центральный атом углерода имеет sp-гибридизацию. Поэтому вся исходящая от него система связей линейна; обе p-связи и концевые заместители расположены во взаимно перпендикулярных плоскостях:
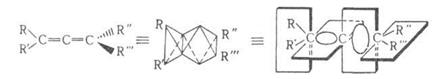
Вследствие этого взаимное влияние заместителей минимально, а при несимметричном замещении для алленов характерна оптическая изомерия.
В природе соединения с тремя кумулированными двойными связями (бутатриены) обнаружены в растениях семейства Compositae.
б). Изолированные диены,соединения общей формулы R-HC=CH-(CH2)n-HC=CH-R, в которых двойные связи разделены одной или несколькими метиленовыми группами (СН2). При этом двойные связи практически не взаимодействуют между собой и изолированные алкадиены проявляют классические свойства алкенов.
в). Сопряженные диены,в которых две двойные связи разделены одной простой: R–HC=CН–HC=CH–R. В диеновых углеводородах все четыре атома углерода сопряженной системы имеют sp2-гибридизацию и лежат в одной плоскости. p-Связи также располагаются в одной плоскости и частично перекрываются, то есть формируют единое p-электронное облако (сопряжены):
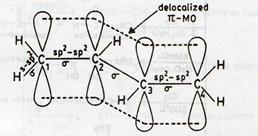
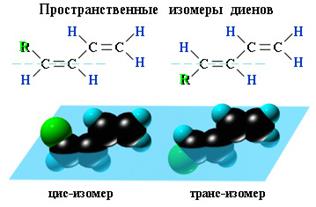
Диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию.
Дата добавления: 2016-11-02; просмотров: 2056;
