Гомологические ряды углеводородов
Предельные углеводороды:
1. Алканы (СnH2n+2, ациклические, все атомы углерода находятся в состоянии sp3-гибридизации).
2. Циклоалканы (СnH2n, циклические, все атомы углерода находятся в состоянии sp3-гибридизации).
Непредельные углеводороды:
1. Алкены (СnH2n, ациклические, атомы углерода находятся в состояниях sp2 и sp3-гибридизации, в молекуле имеется одна двойная связь).
2. Алкадиены (СnH2n-2, ациклические, атомы углерода находятся в состояниях sp2 и sp3-гибридизации, в молекуле имеются две двойные связи).
3. Алкины (СnH2n-2, ациклические, атомы углерода находятся в состояниях sp и sp3-гибридизации, в молекуле имеется одна тройная связь).
Ароматические углеводороды: арены (СnH2n-6, циклические, атомы углерода находятся в состоянии sp2-гибридизации, в молекуле имеется сопряженная система двойных связей).
Алканы
Физические свойства. Алканы, содержащие от одного до четырех атомов углерода – газы; от пяти до шестнадцати атомов углерода – жидкости; остальные – твердые вещества. Температуры плавления и кипения увеличиваются с увеличением числа атомов углерода в молекуле и степени разветвления углеродного скелета. Алканы неполярны и практически нерастворимы в воде, но хорошо растворяются в растворителях с неполярными и малополярными молекулами (эфире, бензоле и др.). В чистом виде алканы бесцветны и имеют слабый запах.
Химические свойства. Ковалентные связи алканов малополярные и очень прочные, поэтому предельные углеводороды в химических реакциях малоактивны. Основными видами химических реакций алканов являются:
1. Галогенирование (реакции радикального замещения, SR):
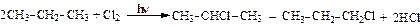
(при хлорировании образуется смесь монохлорзамещенных алканов)
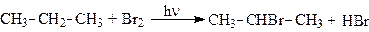
(бромирование идет преимущественно по наименее гидрированному атому углерода:
третичный > вторичный > первичный)
Фторирование алканов идет в темноте при комнатной температуре со взрывом и приводит к разрушению атомов углерод – углерод. Иодирование алканов не происходит.
Образующиеся галогеноалканы (алкилгалогениды) используются для получения алканов с более длинной углеродной цепью, а также соединений других классов (алкенов, спиртов):
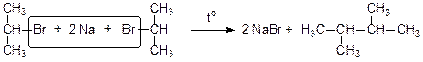
(реакция Вюрца)
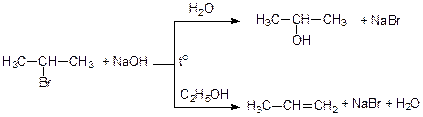
2. Сульфохлорирование.
RН + SO2 + Cl2 → HCl + RSO2Cl (алкилсульфохлорид)
RSO2Cl + NaOH → NaCl + RSO3Na (алкилсульфонат натрия, основа синтетических моющих средств)
3. Нитрование (реакция Коновалова):
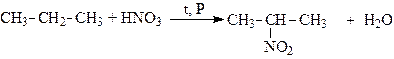
2-нитропропан
Образующиеся нитросоединения восстанавливают различными восстановителями для получения аминов:
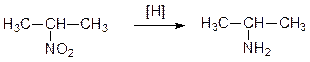
4. Окисление:
СnH2n+2 + (1,5n+0,5)O2 ® nCO2 + (n+1)H2O (горение);
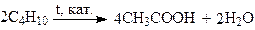
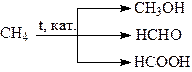
(мягкое или неполное окисление).
5. Изомеризация:
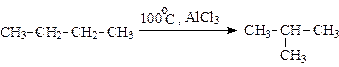
6. Дегидрирование:
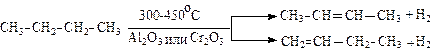
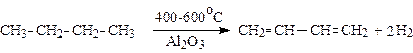
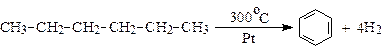
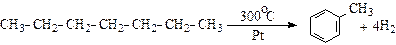
7. Крекинг:
СH4 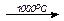 C + 2H2; 2CH4
C + 2H2; 2CH4  C2H2 + 3H2;
C2H2 + 3H2;
С18H38  C9H18 + C9H20
C9H18 + C9H20
алкен алкан
8. Конверсия метана:
CH4 + 2H2O 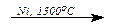 CO2 + 4H2
CO2 + 4H2
Получение алканов
1. Переработка нефти и природного газа;
2.Гидрирование алкенов или алкинов:
CH2=CH2+H2 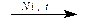 CH3-СH3
CH3-СH3
3.Из галогеноалканов по реакции Вюрца;
4.Декарбоксилирование солей карбоновых кислот:
CH3COONa + NaOH 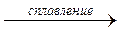 CH4 + Na2CO3;
CH4 + Na2CO3;
5. Электролиз солей карбоновых кислот (синтез Кольбе):
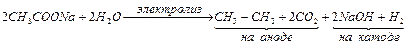 ;
;
6. Гидролиз карбида алюминия: Al4C3 + 12H2O ® 3CH4 + 4Al(OH)3.
Циклоалканы
Химические свойства. Углы между связями в малых циклах – С3Н6 (60°) и С4Н8 (90°) – меньше, чем требует геометрия атома углерода в состоянии sp3-гибридизации (109,5°), поэтому они неустойчивы, для них характерны реакции присоединения, идущие с разрывом цикла:
С4H8 + H2 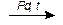 C4H10;
C4H10;
С3H6 + HBr 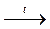 C3H7Br; С3H6 + Br2
C3H7Br; С3H6 + Br2 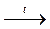 C3H6Br2.
C3H6Br2.
Циклоалканы на основе 5, 6 и 7 атомов углерода (нормальные циклы) химически малоактивны, для них наиболее характерны реакции замещения (аналогично алканам):
С6H12 + Сl2 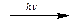 C6H11Cl + HCl.
C6H11Cl + HCl.
Дегидрирование циклогексана приводит к образованию бензола: С6H12 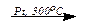 C6H6 +3H2.
C6H6 +3H2.
Дата добавления: 2016-11-02; просмотров: 1651;
