Основні положення молекулярно-кінетичної теорії
1. Молекулярна фізика вивчає тепловий рух. Тепловий рух зумовлює внутрішні властивості тіл, і його вивчення дає змогу зрозуміти багато фізичних процесів, які відбуваються в тілах.
Явища, зумовлені тепловим рухом атомів і молекул, називають тепловими. Вони відіграють важливу роль у природі. Зі зміною температури змінюється все – об’єм і тиск речовин
Молекулярно-кінетична теорія пояснює теплові явища в макроскопічних тілах на основі уявлень, що всі тіла складаються з окремих частинок, які рухаються хаотично.
Теорію, яка пояснює будову і властивості тіл на основі закономірностей руху і взаємодії молекул, називають молекулярно-кінетичною теорією. Значний внесок у створення МКТ зробили: Лавуаз’є, Ломоносов, Больцман (друга половина XIX ст.).
Основні положення МКТ речовини:
1. Будь-які речовини складаються з найдрібніших частинок: молекул і атомів. Підтвердженням цього є кування металу, отримання 1974 року фотографій окремих молекул і атомів, розчинність речовин тощо.
Молекули – найменші частинки, які мають хімічні властивості речовини. Молекули складаються з більш простих частинок – атомів хімічних елементів. У природі є 92 хімічні елементи. Разом із штучними наразі налічується 107 елементів.
Речовину, яка побудована з атомів лише одного виду, називають елементом (водень, кисень, азот тощо). Кожен елемент мас свій номер Z в таблиці Менделєєва
2. Молекули знаходяться в стані неперервного хаотичного (невпорядкованого) руху, що називається тепловим.
Під час нагрівання речовини швидкість теплового руху і кінетична енергія його частинок збільшуються, а під час охолодження зменшуються. Ступінь нагрітості тіла характеризує його температура, яка є мірою середньої кінетичної енергії хаотичного поступального руху молекул цього тіла.
3. Молекули взаємодіють одна з одною, причому на великих відстанях вони притягуються, а на малих – відштовхуються. Сили притягання і відштовхування міме молекулами діють постійно.
2. Молекули різних речовин по-різному взаємодіють одна з одною. Ця взаємодія залежить від типу молекул і відстані між ними. Залежно від характеру руху і взаємодії молекул розрізняють три стани речовини: твердий, рідкий, газоподібний (плазма).
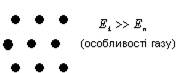 Плазма – сильно іонізований газ (повітря), під дією високих температур. Для газів характерні великі міжмолекулярні відстані, малі сили притягання, тому гази можуть необмежено розширюватись. Молекули газу хаотично рухаються, співударяються одна з одною і зі стінками посудини (рис. 1).
Плазма – сильно іонізований газ (повітря), під дією високих температур. Для газів характерні великі міжмолекулярні відстані, малі сили притягання, тому гази можуть необмежено розширюватись. Молекули газу хаотично рухаються, співударяються одна з одною і зі стінками посудини (рис. 1).
Рис. 1
У рідинах молекули розміщені тісно і коливаються навколо положення рівноваги, а також перескакують з одного рівноважного положення в інше (ближній порядок) (рис. 2).
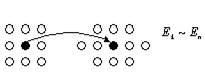
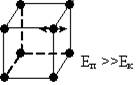
Рис. 2 Рис. 3
У твердих тілах сили взаємодії кожної молекули із сусідніми настільки великі, що молекула здійснює малі коливання навколо деякого сталого положення рівноваги – вузла кристалічних грат – дальній порядок (рис. 3).
3.Молекулярно-кінетичну теорію речовини підтверджено такими дослідами і спостереженнями:
– дослід із змішуванням рідин;
– дослід із розчиненням твердих речовин в рідинах:
– спостереження стисливості речовин;
– деформації твердих тіл;
– броунівський рух;
– спостереження дифузії:
– зображення окремих молекул, отримані за допомогою іонною проектора, електронного мікроскопа;
– рентгеноструктурний аналіз речовин.
Броунівський рух. Броун 1827 року відкрив хаотичний рух спори плауна у воді. Рух завислих частинок відбувався внаслідок руху молекул. Такого ж руху зазнають частинки фарби у воді, пилинки в промені світла тощо. Молекули передають частинкам імпульс, а отже, чинять на частинки тиск.
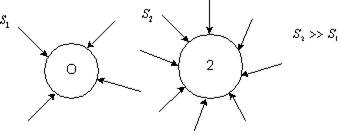 Якщо частинка має малу площу S1, то на одну з її сторін у будь-який момент часу середнє значення тиску може бути більшим, ніж на іншу, тому частинка здійснює безладний рух в об’ємі рідини. Причиною броунівського руху є флуктуація імпульсу, що передається від молекул частинці. Флуктуація – відхилення значення будь-якої величини від середнього. Оскільки S2 >> S1, частинка 2 не здійснює броунівського руху, бо тиск з усіх боків на неї однаковий (рис. 4).
Якщо частинка має малу площу S1, то на одну з її сторін у будь-який момент часу середнє значення тиску може бути більшим, ніж на іншу, тому частинка здійснює безладний рух в об’ємі рідини. Причиною броунівського руху є флуктуація імпульсу, що передається від молекул частинці. Флуктуація – відхилення значення будь-якої величини від середнього. Оскільки S2 >> S1, частинка 2 не здійснює броунівського руху, бо тиск з усіх боків на неї однаковий (рис. 4).
1905 року Ейнштейн розробив кількісну теорію броунівського руху.
Рис. 4
Дифузія – явище спонтанного проникнення молекул контактуючих речовин в міжмолекулярні проміжки кожної з них.
Дифузію, що відбувається через напівпроникні перегородки, називають осмосом.
Приклад дифузії в газах – виникнення запаху, у рідинах – переміщування рідин різної густини. Молекули золота і свинцю внаслідок дифузії протягом 5 років утворюють шар завтовшки 1 см.
З підвищенням температури швидкість дифузії зростає. У природі дифузія сприяє живленню рослин з ґрунту. Без дифузії життя було б неможливим, адже насичення крові киснем і відведення шкідливих речовин – теж дифузія.
Довести існування значних сил притягання між атомами або молекулами можна, зокрема, за допомогою досліду з товстою палицею, яку важко зламати. Але одні лише сили притягання не можуть забезпечити існування стійких атомів й молекул.
Завдяки силам відштовхування молекули не проникають одна в одну.
Хоч молекули електронейтральні, між ними на малих відстанях діють значні електричні сили, бо молекула – складна система, що складається з електронів і ядер атомів. Відбувається взаємодія між електронами і ядрами сусідніх молекул.
4. Більшість молекул неорганічних речовин мають діаметр d ≈ 10-10 м і масу m ≈ 10-26 кг. Гігантами є молекули білків. Характерний розмір молекули дезоксирибонуклеїнової кислоти (ДМК), наприклад, досягає кількох сантиметрів.
Для зручності розрахунків ввели поняття „відносна атомна (молекулярна) маса”:
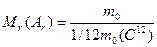 ,
,
де Мr{Аr) – відносна молекулярна (атомна) маса; m0 – маса атома або молекули довільної речовини; 1/12 m0(С12) = 1 а. о. м. = 1,66∙10-27 кг – маса 1/12 частини маси атома карбону.
Величину 1/12 m0(С12) використовують для порівняння з масою молекули (атома) через те, що карбон є дуже поширеною речовиною, на цю величину майже націло діляться всі маси атомів хімічних елементів.
Відносну молекулярну масу речовин, молекули яких складаються з декількох атомів, находять за формулою
Mr = Ar1n1 + Ar2n2 + … + Arknk.
Наприклад, для H2O: Mr = 1∙2 + 16∙1 = 18; для Сu: Mr = 1∙64 = 64 = Аr.
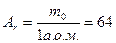
Кількість атомів, що міститься в 0,012 кг ізотопу карбону (С12) дорівнює числу Авогадро: NA = 6,02∙1023 (1/моль).
У молекулярній фізиці виникла потреба введення нової одиниці вимірювання кількості речовини – моля. В 1 молі будь-якої речовини міститься однакова кількість молекул або атомів. Кількість молів структурних одиниць речовини знаходять, за формулою: 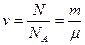 ,
,
де N – кількість молекул або атомів (структурних одиниць) в певній масі речовини: m – маса речовини: μ – молярна маса – маса одного моля структурних одиниць речовини: μ = m0NA (маса однієї молекули, помножена на сталу Авогадро) або μ = Мr∙1 а. о. м.∙NA,:
μ = Мr∙10-3 кг/моль.
Для молекули Н2О: μ = 18∙10-3 кг/моль або 18 г/моль.
Вираз для розрахунку кількості атомів або молекул речовини певної маси: 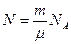 .
.
Сучасними методами уже знайдено розміри молекул. Наприклад, лінійні розміри молекул кисню становлять 3∙10-10 м, а молекули водню – 2,6∙10-10 м.
1.
| <== предыдущая лекция | | | следующая лекция ==> |
| Тенденции развития исламских финансов в мире | | | ПОДАТКИ І ПОДАТКОВА СИСТЕМА |
Дата добавления: 2016-10-17; просмотров: 1026;
