Второе начало термодинамики. Энтропия
Первое начало термодинамики недостаточно для полного описания систем, так как оно не указывает направление протекания процессов. Многочисленные наблюдения и опыты показывают, что все реальные тепловые процессы необратимы. Процесс называется необратимым, если в результате его система не может повторить всю последовательность состояний в обратном направлении. Проиллюстрируем на примерах. Газ, находящийся в части сосуда, отделенный от другой части перегородкой, заполняет весь сосуд, если удалить перегородку. Без постороннего вмешательства, самостоятельно газ не соберется в той части сосуда, где он находился первоначально. Если привести в соприкосновение два тела с различной температурой, то тепло перейдет от нагретого тела к холодному и их температуры выровняются. Обратный процесс самопроизвольно никогда не произойдет. В природе существует универсальная тенденция стремления изолированной системы к равновесному состоянию. Отметим, что находящаяся в тепловом равновесии термодинамическая система не способна совершать работу, так как работа связана с механическим движением, т.е. переходом тепловой энергии в механическую.
Для математического описания необратимых процессов кроме внутренней энергии U вводятся другие функции состояния: свободная энергия F - часть внутренней энергии системы, которая может быть превращена в полезную механическую энергию (работу), энтропия S – мера необратимого рассеяния энергии, ее «обесценивания». Все три функции состояния при T = const связаны между собой соотношением:
U = F + TS. (5.3)
Здесь произведение TS определяет «обесцененную» энергию – часть внутренней энергии системы, которая не может быть передана в форме полезной механической энергии.
Особое значение, выходящее за рамки термодинамики, имеет понятие «энтропия». Оно характеризует удаленность системы от теплового равновесия. Если энтропия S растет, то система приближается к тепловому равновесию, если энтропия S уменьшается, то система удаляется от состояния теплового равновесия. Изменение энтропии системы за счет внутренних процессов называется производством энтропии(diS, здесь индекс «i» означает «внутри» - «intra»). Р.Ю. Клаузиусом установлен закон - второе начало термодинамики, определяющее направление тепловых процессов в изолированных системах: при любых происходящих в изолированной системе тепловых процессах система стремится к равновесному состоянию, при этом энтропия системы возрастает и достигает максимального значения в тепловом равновесии. Этот закон можно сформулировать более лаконично: в изолированной системе энтропия не убывает
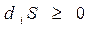 . (5.4)
. (5.4)
Л. Больцман дал статистическую трактовку этого закона, введя понятие термодинамической вероятности. Необратимость тепловых процессов имеет вероятностный характер. Переход системы из равновесного состояния в неравновесное не совсем невозможен, а лишь подавляюще маловероятен (принцип порядка Больцмана). Термодинамическая вероятность (ω) состояния системы (рис. 5.1) – это число микросостояний(конкретных распределений нумерованных частиц), осуществляющих данное макросостояние системы с определенными термодинамическими параметрами. Энтропия S связана с термодинамической вероятностью состояния выражением
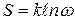 , (5.5)
, (5.5)
где k – постоянная Больцмана.
 |  |










 |  |  |  |
а б
Рис. 5.1 Два различных распределения молекул между двумя отсеками:
а) N=N1=12; N2=0; б) N1=N2=6.
Со временем распределения б представляет наиболее вероятную конфигурацию - аналог термодинамического равновесия.
Из рис. 5.1 видно, что если частицы пронумеровать, то состояние а может реализоваться только одним распределением частиц (все – в левой части), тогда как состояние б – большим числом распределений. Следовательно, это наиболее вероятное состояние. При этом оно равновесное и максимально беспорядочное. Из формулы (5.5) следует, что энтропия характеризует меру беспорядка(хаоса) системы. Тогда второе начало термодинамики приобретает еще один аспект: при необратимых процессах, происходящих в изолированной системе, вероятность состояния и беспорядок возрастают.В равновесном состоянии энтропия максимальна, ее изменение и направленные процессы прекращаются.
Значение второго начала термодинамики выходит за рамки описания тепловых процессов. Этот закон используется при рассмотрении проблем космологии, теории информации, экономики, эволюционного развития и процессов самоорганизации. Приведем пример из экономики. Экономическая система – фирма (предприятие) производит товар, осуществляя упорядоченный направленный процесс. Однако товар не реализуется на рынке и затоваривает склады. С точки зрения второго начала такая экономическая система является изолированной, она производит энтропию, которая возрастает и достигнет максимального значения, когда направленный процесс прекратится: предприятие затоварится и прекратит производство.
Стрела времени
 В механике (классической и квантовой) движение обратимо, т.е. в уравнениях движения знак времени может меняться на противоположный, и, следовательно, механическая система способна вернуться к первоначальному состоянию, т.е. в прошлое. Механическая система «не различает» прошлое и будущее. Такое представление о времени не отражает внутренних изменений, которые происходят в биологических (живых), социально-экономических и других системах, испытывающих необратимые процессы и имеющих свою историю. Изучение тепловых процессов привело к иному пониманию времени, учитывающему его направленность. В изолированной термодинамической системе направление необратимого возрастания энтропии задает направление времени, определяя «стрелу времени». Время как внутреннее свойство системы позволяет считать более старым из двух состояний то, которому соответствует большее значение энтропии. В отличие от механической, термодинамическая система «различает» прошлое и будущее. Энтропия устанавливает это различие.
В механике (классической и квантовой) движение обратимо, т.е. в уравнениях движения знак времени может меняться на противоположный, и, следовательно, механическая система способна вернуться к первоначальному состоянию, т.е. в прошлое. Механическая система «не различает» прошлое и будущее. Такое представление о времени не отражает внутренних изменений, которые происходят в биологических (живых), социально-экономических и других системах, испытывающих необратимые процессы и имеющих свою историю. Изучение тепловых процессов привело к иному пониманию времени, учитывающему его направленность. В изолированной термодинамической системе направление необратимого возрастания энтропии задает направление времени, определяя «стрелу времени». Время как внутреннее свойство системы позволяет считать более старым из двух состояний то, которому соответствует большее значение энтропии. В отличие от механической, термодинамическая система «различает» прошлое и будущее. Энтропия устанавливает это различие.
Таким образом, из второго начала термодинамики, которое можно представить в виде закона возрастания энтропии, вытекает существование «стрелы времени». Кроме того, анализ необратимости процессов приводит к новой концепции времени как внутренней переменной системы, характеризующей ее внутреннее состояние.
Дата добавления: 2016-10-17; просмотров: 920;
