Построение градуировочного графика
1. Для построения градуировочного графика в колбы вносят 0,0; 0,1; 0,5; 1,0; 1,5; 2,5; 3,0; 3,5; 4,0 мл стандартного раствора кобальта, содержащего 10 мкг/мл Со, объем доводят до 60 мл буферным раствором.
2. Содержимое колб перемешивают, переносят в стаканы, прибавляют по 1 мл концентрированной азотной кислоты и пероксида водорода.
3. Смесь нагревают до кристаллизации солей. Операцию повторяют дважды и затем обрабатывают в условиях анализа пробы.
4. Окрашенные растворы стандартов фотометрируют при длине волны 536 нм по отношению к дистиллированной воде.
5. По полученным средним результатам из пяти определений каждого стандарта строят график зависимости оптической плотности от содержания кобальта (мкг).
Ход работы
1. Помещают 30 г воздушно-сухой почвы в колбу с притертой пробкой емкостью 500 мл. Прибавляют 150 мл буферного раствора и периодически взбалтывают круговыми движениями 10 мин.
2. Колбу устанавливают на ротатор и встряхивают 30 мин, затем раствор фильтруют через фильтр "синяя лента".
3. Переносят 60 мл фильтрата в стакан, прибавляют 1 мл концентрированной азотной кислоты, 1 мл раствора пероксида водорода и выпаривают до кристаллизации солей. Операцию повторяют дважды.
4. Остаток растворяют в 10 мл воды, добавляют 5 капель концентрированной азотной кислоты и доводят до кипения, приливают 1 мл 20 %-го раствора цитрата натрия, 1 мл 40%-го раствора ацетата натрия, рН раствора должен быть 5,5. При необходимости доводят рН до 5,5, добавляя раствор ацетата натрия.
5. К анализируемому раствору прибавляют 1 мл раствора нитрозо-R-соли, 5 мл воды и доводят до кипения.
6. Раствор переносят в пробирку и доводят объем до 10 мл (если объем меньше 10 мл) или до 20 мл (если больше 10 мл) и измеряют оптическую плотность при длине волны 536 нм по отношению к дистиллированной воде.
7. Содержание кобальта в пробе находят по градуировочному графику. Концентрацию кобальта в почве С (мг/кг) вычисляют по формуле (4)
С = 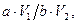 (4)
(4)
где а – содержание кобальта, найденное по градуировочному графику, мкг; V1 – общий объем раствора пробы, мл; V2 – объем раствора пробы, используемый для анализа, мл; b – масса исследуемой почвы, г.
8. По окончании работы делают выводы.
Основными источниками загрязнения агросферы никелем являются сжигание топлива, цветная и черная металлургия, осадки сточных вод промышленности и коммунального хозяйства. Стоит отметить, что в кислой среде никель более подвижен, чем в нейтральной или щелочной.
Никель необходим растениям в очень малых количествах. В водных культурах никель очень токсичен для растений (кукуруза, бобы) в дозе 2 мг/л. Более токсичен никель для растений на кислых почвах. Высоким потреблением никеля отличаются растения семейства астровых и бурачниковых, низким – розоцветные. Никель способен изменять активность окислительно-восстановительных процессов, влияет на поглотительную способность корней, задерживает поступление железа. При его повышенном содержании происходит угнетение роста растений, снижается содержание хлорофилла в листьях.
При загрязнении кормов никелем происходит эндемичное заболевание у животных, ухудшается зрение вследствие накопления его роговицей глаз, возникает заболевание рака полости рта и толстой кишки.
Марганец принимает участие в процессах фотосинтеза, дыхания, азотном и нуклеиновом обменах. Оказывает прямое воздействие на рост и развитие растений, их химический состав. При избытке марганца в почве содержание железа снижается и у растений наблюдается хлороз. Марганец в почве находится в двух-, трех- и четырехвалентном состоянии. Принимает участие в почвообразовании. Растениям наиболее доступен марганец, находящийся в гумусовом горизонте.
Содержание подвижного марганца зависит от рН почвенного раствора и механического состава почвы. В кислых почвах его больше, в песчаных и супесчаных меньше. Известкование снижает его подвижность и поступление в растения. Наиболее чувствительны к недостатку марганца овес, сахарная свекла, картофель.
ЛАБОРАТОРНАЯ РАБОТА
«Определение марганца в почве»
Соединения марганца растворимы в воде и являются сильными окислителями. Кроме того, марганец принадлежит к группе тяжелых металлов. Предельно допустимая концентрация составляет 2 мг/кг почвы.
Определение основано на окислении ионов марганца персульфатом аммония в сильнокислом растворе, в присутствии нитрата серебра и фосфорной кислоты и последующем анализе окрашенного раcтвоpa.
Оборудование и реактивы: спектрофотометр Spekol или фотометр КФК; аппарат для встряхивания; плитка электрическая; ступка фарфоровая; сито с отверстиями диаметром 1 мм; посуда мерная стеклянная; фильтры бумажные "синяя лента"; серная кислота, пл.1,84 г/см3, 0,1%-й и 10 %-й растворы; азотная кислота, пл.1,4 г/см3; пероксид водорода, 30 %-й раствор; ортофосфорная кислота пл.1,7 г/см3; нитрат серебра, 1%-й раствор; персульфат аммония; перманганат калия 0,1 н и 0,001 н растворы; дистиллированная вода.
Ход работы
1. Построение градуировочного графика. Для построения градуировочного графика в мерные колбы емкостью 50 мл вносят 2,0; 5,0; 10,0; 20,0; 25,0 мл 0,001 н раствора перманганата калия и объем доводят до метки дистиллированной водой.
2. Измеряют оптическую плотность окрашенных растворов при длине волны 530 нм. По результатам строят график зависимости оптической плотности от объема раствора перманганата калия, мл.
3. Почву доводят до воздушно-сухого состояния, просеивают через сито.
4. Помещают 5 г почвы в колбу с притертой пробкой, приливают 50 мл 0,1 н серной кислоты и встряхивают на аппарате 1 ч.
5. Смесь фильтруют, 10 мл фильтрата помещают в стакан емкостью 50 мл, приливают 5 мл азотной кислоты и 2 мл пероксида водорода, выпаривают до сухого остатка.
6. Остаток растворяют в 25 мл 10%-й серной кислоты, нагревая его дно до полного растворения.
7. К раствору приливают 15 мл воды, 2 мл 1%-го раствора нитрата серебра и 2 мл ортофосфорной кислоты. Смесь нагревают 5–10 мин на электрической плитке. Если раствор помутнеет, его фильтруют.
8. К раствору прибавляют 2 г персульфата аммония (малыми порциями), перемешивают и ставят на горячую электрическую плитку на 10–15 мин для окисления марганца. По окончании выделения пузырьков озона раствор охлаждают, переливают в мерную колбу объемом 50 мл и доводят до метки дистиллированной водой.
9. Измеряют оптическую плотность раствора при длине волны 530 нм по отношению к 5 %-й серной кислоте. Содержание перманганата калия (мл) при анализе проб находят по градуированному графику.
10. Концентрацию марганца в пробе С (мг/кг) вычисляют по формуле (5)
С = 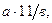 (5)
(5)
где а – содержание 0, 001н раствора перманганата калия, найденное по градуировочному графику, мл; 11 – содержание марганца в 1 мл 0,001 н раствора перманганата калия, мкг/мл; в – масса почвы, соответствующая исследуемому объему раствора пробы, г.
11. Делают вывод.
Источники поступления меди в экосистемы: выбросы металлургических предприятий, минеральные и органические удобрения, осадки сточных вод. Из всех минеральных удобрений наибольшее количество меди содержится в простом суперфосфате. В 20 т навоза содержится 40 г меди. Сточные воды, в осадке которых содержится свыше 800 мг/кг меди, не разрешается использовать в сельскохозяйственном производстве. Очень низкое содержание меди в почвах с высоким рН. Содержание в земной коре составляет 4,5 мг/кг, морской воде 1–25 мкг/кг, организме взрослого человека около 100 мг. Медь усиливает токсичность фтора.
Физиологическая роль в растениях меди определяется ее вхождением в состав медьсодержащих белков и 19 ферментов. Определенную роль играет в азотном обмене, входя в состав фермента нитритредуктазы. Под действием меди усиливается прочность хлорофилл-белкового комплекса, снижается степень разрушения хлорофилла в темноте. Повышает устойчивость растений к полеганию, способствует увеличению засухо-, морозо-, жароустойчивости растений. При дефиците задерживается рост растений, проявляются хлороз и увядание, задерживается цветение, падает продуктивность.
Медь, в отличие от ртути и мышьяка, принимает активное участие в процессах жизнедеятельности, входя в состав ряда ферментных систем. Суточная потребность составляет 4–5 мг. При недостатке или избытке меди в почве и растениях у человека развиваются заболевания костной ткани – эндемическая анемия, эндемический деформирующий артроз.
В организме присутствуют механизмы биотрансформации меди. При длительном воздействии высоких доз меди наступает «поломка» механизмов адаптации, переходящая в интоксикацию и специфическое заболевание.
Дата добавления: 2016-09-20; просмотров: 1841;
