Водно-хімічний режим оборотних систем водопостачання
Режим роботи оборотних систем різко відрізняється від прямоточних систем. Вода багаторазово підігрівається, охолоджується, випаровується, розбризкується та виноситься потоком повітря. Крім того, вода змінює свій хімічний склад внаслідок випаровування та підживлення свіжою водою.
Дуже важливими показниками водно-хімічного режиму систем оборотного водопостачання є водний та сольовий (матеріальний) баланси.
Водяний режим в оборотних системах характеризується зміною якісних показників води та впливом її на споруди. Так, в результаті випаровування в охолоджувачах частини води підвищується концентрація мінеральних солей, розчинних у циркуляційній воді систем оборотного водопостачання. При певних концентраціях солі тимчасової жорсткості (головним чином карбонат кальцію СаСО3) можуть випадати з неї у теплообмінниках, що різко знижує коефіцієнт теплопередачі та погіршує експлуатаційні показники.
Для запобіганню випадінню солей жорсткості здійснюється постійна продувка систем оборотного водопостачання, тобто видалення з неї частин циркуляційної води.
Втрати води на продувку, винос та випаровування повинні бути компенсовані додаванням у систему свіжої додаткової води.
Стабілізація сольового складу буде спостерігатися при умові, якщо кількість солей, що виводяться з системи за рахунок продувки та в результаті бризкоуносу води з охолоджувача буде дорівнювати кількості солей, що надходить з додатковою водою.
Солі, що надходять у систему водопостачання слід розподіляти на дві основні групи:
1. Солі, що добре розчиняються у воді (не випадають у осад ні при яких умовах роботи системи, це хлориди калію, натрію, кальцію та магнію).
2. Солі, які внаслідок недостатньої розчинності при порушенні вуглекислотної рівноваги випадають у осад.
В практиці водопідготовки стабільною прийнято називати воду, яка при визначеній температурі не здібна виділяти нерозчинні сполуки карбонату кальцію та не є агресивною, тобто не руйнує конструкційні матеріали. В якості основної умови такої стабільності є співвідношення між розчиненою у воді вільною вуглекислотою і іонами кальцію.
Вуглекислотна рівновага – це рівновага між розчиненою у воді вуглекислотою та іонами кальцію.
Надмір вільної вуглекислот над рівновагою зветься агресивною вуглекислотою. Вода з надлишком вуглекислоти здатна розчиняти захисну карбонатну плівку, що приводить до корозії металу та руйнування бетону.
Внаслідок втрати вуглекислоти бікарбонати переходять у карбонати кальцію та відкладаються на стінках. Це відбувається внаслідок підігріву води.
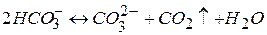 (3.1)
(3.1)
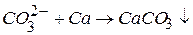 . (3.2)
. (3.2)
Якщо додати деяку кількість вільної вуглекислоти, рівновага зрушиться ліворуч і відбудеться розчинення карбонату кальцію.
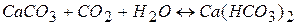 . (3.3)
. (3.3)
Співвідношення між різними формами вуглекислоти залежать від визначеної температури та від активності іонів водню, тобто рН розчину.
Дата добавления: 2016-09-20; просмотров: 631;
