КЛАССИФИКАЦИЯ МЕТОДОВ ИЗУЧЕНИЯ БИОСУБСТРАТОВ
Все лабораторные методы изучения биосубстратов могут быть разделены на два класса:
— препаративные методы, связанные с получением из исходной биопробы некоторого (или нескольких) ее компонента;
— аналитические методы, позволяющие не только обнаружить, но и количественно оценить параметры обнаруженного компонента.
Препаративные методы применяются для разделения биосубстрата на составляющие его компоненты для последующего исследования. В дальнейшем продукт, полученный препаративным методом, может быть изучен с помощью того или иного аналитического метода, например для оценки его качества.
Отличием любого аналитического метода является то обстоятельство, что внешнее энергетическое воздействие всегда используется для получения измерительного эффекта, в то время как в препаративных методах внешние энергетические воздействия применяются только лишь для разделения вещества на составляющие его компоненты.
Изучаемые свойства биопробы являются определяющими при выборе типа измерительных преобразователей, они задают алгоритмы обработки сигналов и способы представления результатов.
Другие критерии классификации:
1.Вид анализа: качественный, количественный, структурный.
При качественном анализе (идентификации) определяется состав исследуемого материала, при этом выясняют, из каких атомов, молекул, ионов и радикалов состоит вещество пробы.
Для количественного анализа характерно определение количественных соотношений между компонентами пробы либо концентрации конкретного компонента.
Структурный анализ позволяет выявить взаимное расположение атомов (молекул) вещества в пространстве.
2. Степень избирательности (специфичности или селективности) метода. Высокоизбирательными являются методы, с помощью которых можно определить наличие конкретного вещества в средах сложного состава с близкими характеристиками различных компонентов (например, полярография, атомно-абсорбционная спектроскопия и др.).
3. Количество вещества, необходимого для анализа. По объему биопробы различают: макропробы — 0,5–100 г, полумикропробы — 0,01–0,5 г, микропробы — 0,001–0,01 г, ультрамикропробы — менее 0,001 г. Необходимо учитывать, что выбор метода часто определяется тем количеством биосубстрата, которое имеется в распоряжении исследователя.
4. Наличие математической или иным способом установленной зависимости между интенсивностью сигнала на выходе анализатора и концентрацией исследуемого компонента. Различают абсолютные и относительные методы исследования.
Абсолютными называются такие методы, для которых известна точная математическая зависимость между значением измеряемого физического параметра и исследуемым свойством пробы.
Вот несколько примеров таких измерений. Для метода гравиметрии известно, что масса вещества строго зависит от концентрации. В методах титрования объем добавленного титранта определяет количество исходного компонента, вступившего в реакцию. В кулонометрии используется закон Фарадея, связывающий массу вещества на электроде с количеством электричества, затраченного на восстановление. Оптическая плотность раствора в соответствии с законом Бугера-Ламберта-Бэра пропорциональна концентрации молекул поглотителя лучистого потока.
Большинство современных аналитических методов являются относительными: исследователь сам в фиксированных условиях конкретного эксперимента устанавливает соотношение между интенсивностью аналитического сигнала и концентрацией исследуемого вещества. Такая процедура называется градуировкой (калибровкой) сигнала (метод калибровочного графика). При этом требуется использование некоторого объекта, который принимается за эталон, причем важно, чтобы его свойства были стабильными, неизменными во времени.
5. Основной критерий - Характерное свойство анализируемого компонента, которое проявляется и фиксируется в процессе анализа. Три класса аналитических методов: химические, биологические и физико-химические.
В основе группы химических методов лежит использование химических реакций (химического взаимодействия молекул), при которых легко фиксируется параметр реакции, однозначно связанный с изучаемым свойством, например, с концентрацией компонента в исходной биопробе. Как правило, это реакции типа:
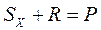 ,
,
где 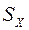 — исследуемый компонент;
— исследуемый компонент; 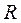 — реагент;
— реагент; 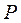 — продукт реакции.
— продукт реакции.
В основе биологических методов — методов биотестирования — лежит свойство живых организмов давать характерный отклик на воздействие окружающей среды измененного химического состава. В роли организмов-биоиндикаторов могут выступать живые клетки организмов, микроорганизмы, плесневые грибы, насекомые, рыбы и другие представители биологического мира.
Известно, что любые организмы для своей жизнедеятельности требуют среды строго определенного химического состава. Если его изменить, исключив из питательной среды некоторый компонент или введя его дополнительно, то организмы через определенное время обязательно подадут соответствующий отклик — тоже своеобразный аналитический сигнал, на основе которого можно построить техническое средство для изучения реакций популяции. Такой сигнал может быть выражен изменением характера поведения, интенсивностью роста и размножения (для микроорганизмов, животных клеток), изменениями физиологических функций кровообращения, пищеварения, дыхания (для сложных организмов) и т. д.
Чаще всего методы этой группы используются в целях биотестирования объектов ОС для группового обнаружения некоторых вредных компонентов в очень малых концентрациях — ионов тяжелых металлов, пестицидов, биологически активных веществ (БАВ) и др.
Физико-химические методы. С помощью этих методов удается непосредственно оценить тип, концентрацию и свойства путем измерения значений физических параметров исследуемой биопробы. Эти методы также можно разбить на несколько подгрупп:
— механические методы, основанные на измерении пара-метров механических свойств вещества (объем, плотность, вязкость, проницаемость и т. п.);
— электрохимические методы, основанные на измерении параметров электрических свойств вещества (сопротивление или проводимость, импеданс, потенциал, количества электричества и т. п.);
— миграционные методы, в которых до начала измерения параметров отдельных компонентов присутствует обязательный этап предварительного разделения биопробы на компоненты. При этом существуют два варианта разделения — за счет взаимодействия каждой компоненты с другими, специально введенными веществами или при воздействии биопробы с внешним полем, при котором скорости перемещения отдельных компонентов различаются. (Используются при пробоподготовке) Делятся на:
-электрофоретические методы, в которых используются процессы электрофореза — миграции (перемещения) заряженных частиц в жидкой среде во внешних электрических полях;
- хроматографические методы, в основе которых лежат процессы хроматографии — неравномерного распределения (разделения) компонентов смеси между веществами неподвижной (стационарной) и подвижной фаз, обусловленные различным сродством компонентов биопробы к этим фазам.
— методы с излучениями, основанные на взаимодействии вещества пробы с различными (внешними или собственными) излучениями; можно выделить две подгруппы — оптические методы и методы, основанные на эффектах ядерной физики.
Оптические методы измерения основаны на использовании различных физико-химических явлений, возникающих при взаимодействии излучения оптического диапазона с веществом пробы: изменении интенсивности, фазы, пространственной ориентации, спектрального состава излучений и т. п. Нашли применение все три оптических диапазона электромагнитного излучения — ультрафиолетовый, видимый и инфракрасный.
Оптические методы широко используются в аналитических лабораториях.
Большую подгруппу оптических методов составляют также методы спектрального анализа, в которых для изучения состава биопробы и определения концентраций компонентов исследуются оптические спектры излучения и поглощения вещества. В спектральном анализе можно выделить как методически, так и по области применения: атомно-эмиссионный, в том числе и метод пламенной фотометрии; атомно-абсорбционный и атомно-флуоресцентный анализ. Данные методы отличаются необходимостью предварительного перевода исследуемой пробы в атомарное состояние.
Методы лабораторного анализа, основанные на эффектах ядерных взаимодействий, включают ряд методов (масс-спектрометрия, гамма-спектрометрия, рентгеноструктурные методы, электронная микроскопия и др.), позволяющих изучать тонкую структуру многокомпонентных биопроб. Они основаны на взаимодействиях вещества с различного рода проникающими (волновыми и корпускулярными) излучениями, эффекты которых проявляются на молекулярном и атомарном уровнях.
— многофакторные методы, основанные на формировании измерительного сигнала при одновременном воздействии нескольких внешних факторов, например, двух физических полей разного типа или разных параметров. Такие методы в основном используются при научных исследованиях и редко применяются в клинических лабораториях.
Приведем краткую характеристику первых четырех групп.
Группа 1. В практике лабораторного анализа наибольшее распространение получили методы измерения объемов, удельного веса, вязкости и сил поверхностного натяжения, размеров и массы дисперсных фаз, параметров движения частиц, взвешенных в жидкой среде под действием гравитационных полей. Разрабатываются также методы, основанные на измерении параметров распространения звуковых и ультразвуковых волн в веществе пробы. Это простые и доступные в методическом отношении методы, не требующие для выполнения исследований сложной измерительной техники. Аналитические возможности методов из этой группы ограничены, но они нашли применение в качестве препаративных при подготовке биопробы к последующему анализу.
Группа 2. Методы данной группы, как правило, базируются на взаимодействии молекул биопробы с электронами на поверхности электродов с последующим образованием ионов (реакции окисления и восстановления) или на регистрации ее электрических характеристик (электрического импеданса, проводимости, диэлектрической проницаемости и др.). Эти методы позволяют кодировать информацию о свойствах вещества непосредственно в форме электрического сигнала, наиболее удобной для дальнейшего преобразования. А общая черта, объединяющая электрохимические методы в одну подгруппу, заключена в учете комплексного характера взаимодействия объекта исследования (биопробы), электродной системы и электрического поля. В подгруппе представлен широкий диапазон методов, с помощью которых удается определять различные неорганические и органические соединения, ферментативную и иммунную активность, оценивать белковый состав, проводить дисперсионный анализ суспензий и т. п.
Любой из электрохимических методов может быть использован как для прямых измерений, основанных на получении зависимости аналитического сигнала от состава вещества или выраженности свойства биопробы, так и для косвенных методов (например, при индикации конечной точки титрования). Эта группа методов нашла применение и при решении препаративных задач.
Группа 3. Эта группа включает две основные подгруппы:
— электрофоретические методы, в которых используются процессы электрофореза — миграции (перемещения) заряженных частиц в жидкой среде во внешних электрических полях;
— хроматографические методы, в основе которых лежат процессы хроматографии — неравномерного распределения (разделения) компонентов смеси между веществами неподвижной (стационарной) и подвижной фаз, обусловленные различным сродством компонентов биопробы к этим фазам.
Электромиграционные методы позволяют проводить идентификацию и определение концентрации различных макромолекул, микрочастиц, клеток по их подвижности в направлении силовых линий электрического поля. Они играют важную роль в исследованиях белков и их компонентов, нуклеиновых кислот, пептидов, аминокислот и т. п., поскольку, используя незначительные количества исследуемого вещества, дают возможность проводить очень тонкое фракционирование. Методы позволяют быстро решить вопрос о качественном и количественном составе исследуемой биопробы, а также проверить чистоту белковых препаратов, полученных любыми способами.
Известны и другие методы, использующие миграционные эффекты под действием внешнего поля, например, такие, как магнитомиграционные методы (магнитофорез), основанные на эффекте перемещения компонент биопробы с разной скоростью при воздействии магнитными полями. Но они пока не нашли широкого применения в практике изучения биологических материалов.
Следует обратить внимание на то, что многие методы разделения и концентрирования, отнесенные к первой группе, такие, как отгонка, седиментация, диализ, мембранные методы, экстракция, фильтрование, ионный обмен и т. п., как раз относятся к классу препаративных и в первую очередь используются для выделения конкретных веществ либо для проведения пробоподготовки. Это связано с тем, что одна из основных задач пробоподготовки состоит в выделении (концентрировании) из исследуемого вещества пробы отдельных фракций и компонентов, необходимых для дальнейшего анализа. Как правило, в этом случае используется один из нескольких приемов, осуществляемых посредством специального оборудования:
— физико-механический принцип разделения, например центрифугирование;
— электрофоретическое разделение;
— сорбционное разделение.
В качестве иллюстрации особенностей препаративного анализа рассмотрим типовую технологическую процедуру разделения исходного биосубстрата для определения содержания в пробе конкретного компонента — белка (рис. 2.1).
Процедура выделения белка начинается с проведения экстракции— процесса извлечения при помощи растворителя отдельных компонентов сложной смеси. Последующие операции по выделению и очистке должны:
— обеспечивать быстрое отделение целевого компонента от сопутствующих примесей;
— обеспечивать высокую степень очистки;
— допускать обработку больших объемов жидкостей.
Набор методов, включенных в описываемую процедуру, обеспечивает эти требования для анализа большой группы биосубстратов.
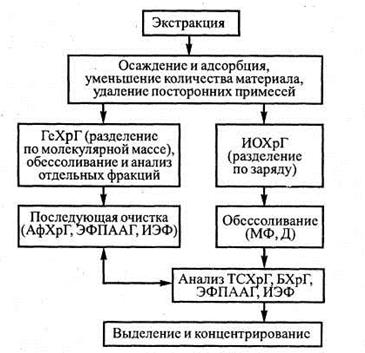
Рис. 2.1. Типовая технологическая процедура разделения биосубстрата для определения содержания белка:
ГеХрГ – гельхроматография; ИОХрГ – ионнообменная хроматография; АфХрГ — аффинная хроматография; ЭФПААГ — электрофорез в полиакриламидном геле; ИЭФ — изоэлектрофокусирование; МФ — мембранная фильтрация; Д – диализ; ТСХрГ — тонкослойная хроматография; БХрГ— бумажная хроматография
Группа 4. Здесь можно выделить две подгруппы, как наиболее развитые в методическом отношении, — оптические методы и методы, основанные на эффектах ядерной физики.
Оптические методы измерения основаны на использовании различных физико-химических явлений, возникающих при взаимодействии излучения оптического диапазона с веществом пробы: изменении интенсивности, фазы, пространственной ориентации, спектрального состава излучений и т. п. Нашли применение все три оптических диапазона электромагнитного излучения — ультрафиолетовый, видимый и инфракрасный.
Оптические методы широко используются в аналитических лабораториях. Анализаторы, с помощью которых реализуются оптические методы, вместе с электрохимическими анализаторами охватывают более 70 % всей лабораторной техники. Они могут быть использованы как для тончайшего микроанализа биологических веществ, так и для измерения важных макропоказателей, характеризующих свойства или концентрацию отдельных компонентов сложных биосубстратов. Оптические свойства разных компонентов полидисперсных гетерогенных сред отличаются, что позволяет судить об их наличии и концентрации путем регистрации параметров одного или нескольких световых потоков, прошедших исследуемую пробу или отраженных от нее; изучаются и собственные излучения биопробы. При использовании специальных методов освещения исследуемых сред, находящихся в жидкой фазе или с помощью методов подготовки высушенных отпечатков биожидкостей на стеклянных или пленочных подложках, можно восстановить пространственное распределение дисперсных фаз, а также оценить параметры отдельных фрагментов, твердых включений, пузырьков газа, клеток, микроорганизмов.
Большую подгруппу оптических методов составляют также методы спектрального анализа, в которых для изучения состава биопробы и определения концентраций компонентов исследуются оптические спектры излучения и поглощения вещества. В спектральном анализе можно выделить как методически, так и по области применения: атомно-эмиссионный, в том числе и метод пламенной фотометрии; атомно-абсорбционный и атомно-флуоресцентный анализ. Данные методы отличаются необходимостью предварительного перевода исследуемой пробы в атомарное состояние.
Методы лабораторного анализа, основанные на эффектах ядерных взаимодействий, включают ряд методов (масс-спектрометрия, гамма-спектрометрия, рентгеноструктурные методы, электронная микроскопия и др.), позволяющих изучать тонкую структуру многокомпонентных биопроб. Они основаны на взаимодействиях вещества с различного рода проникающими (волновыми и корпускулярными) излучениями, эффекты которых проявляются на молекулярном и атомарном уровнях. Эти методы получили достаточно ограниченное распространение в лабораторной практике в связи со сложностью методического и технического обеспечения и необходимостью соблюдения мер защиты обслуживающего персонала от проникающих излучений. Однако они интенсивно развиваются, совершенствуются и становятся все более доступными, чему способствует появление новых медико-биологических и экологических задач, при решении которых подобные методы оказываются наиболее эффективными.
Рассмотренные методы пригодны для изучения биосубстратов как из ВС, так и из ОС. В то же время особенности задач, решаемых при исследовании биоматериалов из разных сред, отражаются на преимущественном выборе методов анализа.
Лекция №3
Дата добавления: 2016-08-08; просмотров: 2687;
