Методи виявлення мікобактерій туберкульозу.
Виявлення КСБ в доставленому матеріалі здійснюється бактеріоскопічним, а МБТ – бактеріологічним (культуральним) і біологічним методами.
Бактеріоскопічний метод.Мікроскопія мазків харкотиння для виявлення кислотостійких бактерій (КСБ) являється найбільш доступним і швидким методом виявлення мікобактерій. Приблизно третина пацієнтів з бактеріовиділеннями може бути виявлена при першій мікроскопії фарбованих мазків. При мікроскопії мазків приготовлених із проб, взятих протягом декількох днів, діагностика бактеріовиділення підвищується до двох третин.
Бактеріоскопічний методохоплює пряму бактеріоскопію мазків із патологічного матеріалу, забарвлених за Цілем-Нільсеном, бактеріоскопію методом флотації, люмінесцентну мікроскопію, фазовоконтрастну мікроскопію.
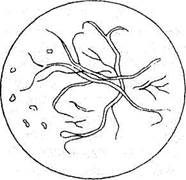
Метод прямої бактеріоскопії. Бактеріоскопічне дослідження мокротиння починається з приготування мазка. Для цього мокротиння змішують з розчином натрію гідрооксиду і центрифугують для отримання осаду. Піпеткою відбирають 1 - 2 краплі осаду і наносять на предметне скельце. Препарат готують, рівномірно розподіляючи його по предметному скельцю і добре висушують на повітрі. Інколи рекомендують робити мазки для мікроскопії із частини осаду залишеного після бактеріологічного посіву на дні центрифужної пробірки. Після того, як мазок добре висохне, його фіксують, тричі проводячи через полум'я горілки, забарвлюють за Цілем-Нільсеном і мікроскопують. При оцінці мазків для виявлення КСБ, збудників туберкульозу, інколи виникає необхідність в диференціації їх від інших кислотостійких паличок. Для цього рекомендується обробити мазок протягом 40 - 60 хвилин етиловим спиртом. Вважається, що патогенні КСБ при такій обробці колір не змінюють, в той же час сапрофітні мікобактерії змінюють його. Після перенесення осаду на предметне скло, його накривають другим покривним скельцем. Препарат вивчають під мікроскопом. У ньому можна побачити лейкоцити, еластичні волокна (рис. 1), а при спеціальному забарвленні – атипові клітини і різні бактерії.
Виявлення у харкотинні тетради С. Д. Ерліха, тобто: 1) звапнених еластичних волокон; 2) кристалів холестерину; 3) вапна у вигляді кристалічних та аморфних утворень; 4) КСБ – свідчить про загострення старого туберкульозного процесу в легенях, нерідко про його розпад.
|
| Рис. 3. Препарат мазка харкотиння. Видно еластичні волокна. |
Мікобактерії забарвлюються за Грамом позитивно. Для виявлення КСБ готують мазок мокротиння, висушують його, фіксують над полум'ям спиртівки, після чого забарвлюють за Цілем-Нільсеном. Забарвлення проводиться спочатку карболовим розчином фуксину. Кислотостійкі бактерії погано сприймають забарвлення, тому розчин фуксину наносять на препарат у великій кількості і підігрівають над полум'ям спиртівки до появи пари. Потім фарбу зливають, препарат промивають у воді і знебарвлюють у 5% розчині сірчаної кислоти або в суміші етилового спирту з розчином соляної кислоти. При цьому всі бактерії і морфологічні елементи мокротиння, крім кислотостійких бактерій, знебарвлюються. Мазок промивають проточною водою, а потім наносять метиленовий синій на 1 - 2 хв. Після цього розчин фарби зливають, мазок промивають і висушують. Препарат вивчають через імерсійну систему мікроскопа, для чого на препарат наносять краплю імерсійного масла, щоб створити однакове середовище між лінзою об'єктива і препаратом.
|
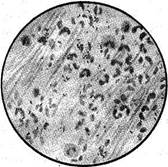
Кислотостійкі бактерії (мікобактерії туберкульозу) під мікроскопом видно забарвленими у червоний колір (рис. 2). Метод забарвлення за Цілем-Нільсеном дає змогу виявити мікобактерії туберкульозу в тих випадках, коли в 1 мл мокротиння міститься близько 5 000 – 10 000 МБТ за умови, якщо проглянуто 300 полів зору і вірогідність позитивного результату досліджень залежить від стадії розвитку збудника та характеру ураження організму.
При невеликій кількості МБТ в харкотинні бактеріоскопічний метод неефективний.
| Рис. 4. Препарат мазку харкотиння. Забарвлення за Цілем - Нільсеном |
Дослідження мокротиння слід проводити протягом трьох днів підряд, а при негативному результаті – застосувати метод флотації (від франц. floter –плавати на поверхні води або лат. fluctuo –носитись на хвилях).
Метод флотації (метод збагачення). Цей метод обов'язково використовується, якщо в досліджуваному матеріалі є мала кількість КСБ, а також при негативному результаті прямої бактеріоскопії. Методом флотації КСБ виявляються у патологічному матеріалі приблизно на 10 – 15% частіше, в порівнянні з прямою бактеріоскопією.
Метод флотації оснований на тому, що при струшуванні двох рідин з різною питомою вагою легша рідина спливає на поверхню одночасно з мікобактеріями туберкульозу, що перебувають у суспензії. Суть методики полягає в тому, що готують водну суспензію з вуглеводню і МБТ. Для дослідження методом флотації харкотиння в об'ємі 12 – 15мл поміщають у колбу 250,0мл, додають таку ж кількість 0,5% розчину їдкого натрію або калію і для кращої гомогенізації струшують протягом 10 - 15 хвилин, потім до половини ємності колби наливають дистильовану воду із додаванням 0,5 мл ксилолу чи бензину. Весь вміст струшують 5 – 10 хвилин, після чого доливають дистильовану воду до повного об'єму – 250мл, через 30 – 60 хвилин крапельки бензину (ксилолу) спливають на поверхню, захоплюючи за собою КСБ і концентруючи їх у невеликому об'ємі утвореного на поверхні кільця. Флотаційне кільце (вершковоподібна піна з КСБ) піпеткою переносять на предметне скельце. Шар піни на предметному склі висушують і наносять новий шар піни з колби. Так нашаровують піну 5-6 разів, після чого мазок фіксують і забарвлюють за Цілем-Нільсеном.
Люмінесцентна мікроскопія. В останні роки все більш широке застосування в мікроскопічній мікробіологічній діагностиці туберкульозу знаходить люмінесцентна мікроскопія. Суть методу полягає в мікроскопії під малим збільшенням і завдяки здатності мікобактерій сприймати люмінесцентні барвники (аурамін, родамін) і потім світитися при опроміненні ультрафіолетовими променями. При цьому залежно від застосованих барвників мікобактерії дають яскраво-червоне світіння на зеленому, чи золотаво-жовте на темно-зеленому фоні поля зору.
Перевагою методу люмінесцентної мікроскопії є можливість проведення досліджень при менших збільшеннях мікроскопа, що забезпечує перегляд в короткий термін більшої кількості полів зору, ніж при звичайній мікроскопії. Можливість виявлення кислотостійких бактерій збільшується на 10 – 15% порівняно із звичайною бактеріоскопією і на 8% – порівняно з методом флотації.
При люмінесцентній мікроскопії необхідно правильно (відповідно до інструкцій) користуватися освітлювальною апаратурою. Дослідження препаратів здійснюється методом мікроскопії (40 х 10). Позитивна відповідь дається при виявленні не менш 3-х клітин мікобактерій у препараті. На темному фоні видно золотисто-жовті кислотостійкі бактерії .
Фазовоконтрастна мікроскопія – цеєдиний мікроскопічний метод дослідження, що дозволяє спостерігати мікобактерії та їх біологічно змінені форми в живому стані. Для проведення такого дослідження застосовують спеціальний фазовоконтрастний пристрій. З методів фазовоконтрастної мікроскопії найбільш широко застосовується методика дослідження препаратів, приготовлених по типу препарату, що одержав назву «роздавлена крапля». Для приготування даного препарату беруть чисте знежирене предметне скельце. На поверхню скельця бактеріальною петлею чи піпеткою наносять краплю рідкої суспензії досліджуваних мікобактерій чи їх біологічно змінених форм, покривають краплю чистим і фламбірованим над полум'ям покривним склом так, щоб між предметним і покривним скельцями не було пухирців повітря. Препарат поміщають на предметний столик мікроскопа і здійснюють мікроскопію з застосуванням спеціального фазовоконтрастного пристрою. При цьому в полі зору мікроскопа стають помітними живі клітини мікобактерій чи їх біологічно змінені форми. Для здійснення фазовоконтрастної мікроскопії імерсійним методом, на поверхню покривного скельця наносять краплю імерсійної олії, занурюють у неї імерсійний об'єктив і здійснюють мікроскопію. При цьому у полі зору спостерігають великі за розмірами живі клітини мікобактерій і їх біологічно змінені форми, окремі деталі їх структури.
При цитологічному дослідженні мокротиння у хворих на туберкульоз легень виявляється незначна кількість нейтрофілів у стадії значної дегенерації на фоні казеозного детриту, скупчення мононуклеарів, гігантських клітин Пирогова- Лангханса, інколи еозинофіли.
У випадках, коли у хворого не вдається отримати мокротиння, досліджують змиви з бронхів.
Дослідження змиву з бронхівпроводиться лікарем. Для цього хворому натще змазують корінь язика, задню стінку глотки і надгортанник 1% розчином лідокаїну. Потім гортанним шприцом вливають у трахею 5 - 10мл ізотонічного розчину натрію хлориду. У хворого зразу виникає сильний кашель і введений ізотонічний розчин натрію хлориду викашлюється на чашку Петрі. Також змив з бронхів (БАЗ – бронхоальвеолярний змив) отримують за допомогою БАЛ – бронхо-альвеолярного лаважу, який проводять під час бронхоскопії. БАЗ досліджують методом флотації або методом посіву. Дослідження змиву з бронхів дає змогу додатково виявляти МБТ у 5 - 10% випадків.
Дата добавления: 2016-08-07; просмотров: 1767;
