Законы идеальных газов.
Слово «газ» произошло от греческого «хаос» - беспорядок. Газообразное состояние вещества является примером существующего в природе полного, совершенного беспорядка во взаимном расположении и движении частиц. Чем более разряженный газ, тем менее влияют силы взаимодействия на тепловое движение молекул, а значит и более точны законы «идеального газа».
Закон Бойля-Мариотта:
P1V1=P2V2, T= const
Закон Гей-Люссака:
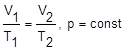
Закон Шарля:
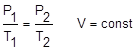
Уравнение состояния идеального газа – уравнение Клайперона-Менделеева:
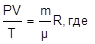
P – давление в паскалях, V –объем в м3,
T – температура в Кельвинах, m – масса в граммах, m - молекулярный вес,
R – универсальная газовая постоянная = 8,3 дж/моль×К.
Закон Дальтона.
Каждый из компонентов газовой смеси распространен во всем пространстве, занимаемой газовой смесью при давлении, какое он развивал бы, занимая все пространство при температуре смеси. Это давление называется парциальным. Давление газовой смеси «Р» равно сумме парциальных давлений ее компонентов.
P=Р1+Р2+Р3+….+Рn
Пример: в баллоне воздух, Р= 10 бар. Удаляем О2 каким-нибудь поглотителем. Давление становится 8 бар, т.е.
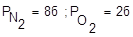
Процессы связанные с переносом тепла, т.е. с нагреванием или охлаждением тел, количественно оцениваются универсальной единицей, применяемой для выражения всех видов энергии – механической, тепловой, электрической и т.п.
Эта единица – Джоуль – единица энергии, равная работе силы в 1 Ньютон при перемещении точки ее приложения на расстояние 1 м в направлении действия силы.
Количество тепла идущее на нагревании тела зависит от разности температур, массы и его теплоемкости, т.е.
Q= m × c (T2-T1)
Удельная теплоемкость – это энергия, необходимая на нагрев единицы массы вещества на 1°. Для воды с=4,2 кдж/ кг×К
Теплоемкость тел уменьшается с падением температуры.
Для газов величина удельной теплоемкости зависит от процесса:
Cp- изобарная теплоемкость
Сv- изохорная теплоемкость
К=ср/cv; для одноатомных газов К=1,67
для двухатомных –1,4
для многоатомных – 1,29.
Процессы сжижения газов удобно рассматривать и производить необходимые расчеты пользуясь диаграммой Молье или давление – энтальния. Эптальпия или теплосодержание – это параметр состояния вещества (рабочего тела).
Удельная энтальния h = u+РV/m, где h – кдж/кг; u – внутренняя (потенциальная) энергия – кдж/кг; P- давление в паскалях, V – объем в м3; m – масса в кг.
Пример: процесс сжижения газа в одноступенчатом цикле:
1-2 - перегрев
2-3 – сжатие в компрессоре
3-4-5 – процесс конденсации
5-6 – дросселирование
6-1 – кипение в испарителе (танке).
*
*
*
*
Дата добавления: 2016-08-07; просмотров: 1153;
