Изомерия положения кратных связей (двойных или тройных), а также заместителей и функциональных групп.
а) Изомерия положения кратных ( двойных или тройных) связей:
CH2 = CH – CH2 – CH3 CH3 – CH = CH – CH3
бутен - 1 бутен – 2
CH ≡ C – CH2 – CH3 CH3 – C ≡ C – CH3
бутин – 1 бутин - 2
б) Изомерия положения заместителей:
CH3 – CH – CH2 – CH2 –CH3 CH3 – CH2 – CH – CH2 – CH3
| |
Cl Cl
2 – хлорпентан 3 – хлорпентан
в) Изомерия положения функциональных групп:
СН3 – СН2 – СН2 – ОН СН3 – СН - СН3
|
ОН
Пропанол – 1 Пропанол – 2
3. Межклассовая изомерия (изомеры принадлежат к разным классам органических соединений):
СН3 – О - СН3 СН3 - СН2 - ОН
Диметиловый эфир этанол
(класс: простые эфиры) (класс: спирты)
Пространственная изомерия (геометрическая и оптическая) – это различное пространственное расположение атомов при одинаковом порядке их соединения.
а) Геометрическая изомерия. Например, бутен – 2 имеет два пространственных изомера:
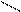

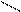
 H H CH3 H
H H CH3 H

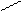
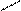
 C = C C = C
C = C C = C
CH3 CH3 H CH3
Цис - бутен - 2 транс - бутен - 2
У цис-изомера одинаковые атомы или группы атомов находятся по одну сторону двойной связи, а у транс-изомера – по разные стороны. Пространственная геометрическая изомерия характерна для соединений с двойной связью.
б) Оптическая изомерия.
Явление оптической изомерии возникает, если молекула несовместима со своим изображением в зеркале.
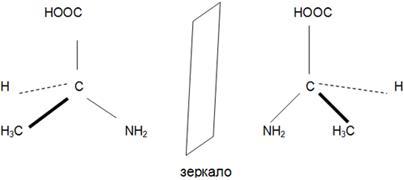
Оптическая изомерия а-аминопропионовой кислоты.
Билет № 8 (2).
Оксиды. Их классификация и характеристика химических свойств. Возможное применение оксидов в вашей профессии.
Оксиды – это сложные вещества, состоящие из двух элементов, один из которых – кислород (в степени окисления –2).
Например, CaO – оксид кальция, CO2 – оксид углерода (II) или углекислый газ, CO – оксид углерода (II) или угарный газ, Al2O3 – оксид алюминия.
Классификация:

 ОКСИДЫ
ОКСИДЫ
Солеобразующие Несолеобразующие


Основные Кислотные
Амфотерные
Несолеобразующие оксиды – те, которые при обычной температуре не взаимодействуют ни с кислотами, ни с основаниями. Это оксид углерода (II) – CO, H2O, оксиды азота – N2O, NO, NO2.
Солеобразующие оксиды – те, которые взаимодействуют с кислотами и основаниями с образованием солей. Солеобразующие оксиды принято делить на три группы:
1. Основные – это оксиды типичных металлов. В основных оксидах металлы проявляют степень окисления +1 или +2. Например, CaO – оксид кальция, MgO – оксид магния, FeO – оксид железа (II). Основным оксидам соответствуют основания.
2. Кислотные – это оксиды неметаллов и металлов с высокими степенями окисления – от +5 до +7. Например, SO2, SO3, N2O5, CO2. Кислотным оксидам соответствуют кислоты.
3. Амфотерные – это оксиды, которые имеют двойственную природу. Они взаимодействуют с кислотами (подобно основным оксидам), и со щелочами (подобно кислотным оксидам). Например, Al2O3 – оксид алюминия, ZnO – оксид цинка, Cr2O3 – оксид хрома (III ).



| <== предыдущая лекция | | | следующая лекция ==> |
| Предварительное проектирование | | | Основные этапы проектирования |
Дата добавления: 2016-05-05; просмотров: 3103;
