Химические свойства. Характерны реакции присоединения, полимеризации (за счет разрыва тройных связей), а также – окисления.
Непредельные углеводороды ряда ацетилена: общая формула, строение. Химические свойства и применение ацетилена в органическом синтезе.
Алкины (ацетиленовые углеводороды) – это углеводороды с общей формулой
Cn H 2n -2 имеющие одну тройную связь между атомами углерода.
Формулы ацетиленовых углеводородов можно вывести из формул предельных углеводородов. Названия образуются путем замены суффикса «ан» на «ин».
Гомологический ряд: C2H2 CH ≡ CH этин (ацетилен)
C3H4 CH ≡ C – CH3 пропин
C4H6 CH ≡ C – CH2 –CH3 бутин - 1
CH3 – C ≡ C – CH3 бутин - 2
Бутин - 1 и бутин –2 - это изомеры по положению тройной связи.
Наибольшее значение из ацетиленовых углеводородов имеет ацетилен.
Физические свойства: ацетилен – это бесцветный газ, легче воздуха, без запаха, мало растворим в воде.
Строение молекулы: молекула ацетилена имеет линейное строение, а атомы углерода в ней соединены одной σ – связью и двумя π – связями, причем π – связи расположены в двух взаимно перпендикулярных плоскостях. Атомы углерода находятся в состоянии SP – гибридизации.
Химические свойства. Характерны реакции присоединения, полимеризации (за счет разрыва тройных связей), а также – окисления.
1) ацетилен присоединяет водород при нагревании, в присутствии катализатора – никеля.
Реакция протекает в две стадии: сначала образуется этилен, а затем – этан:
· 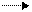 CH ≡ CH + H2 CH2 ═ CH2
CH ≡ CH + H2 CH2 ═ CH2
Ацетилен этилен
· 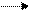 CH2 ═ CH2 + H2 CH3 ― CH3
CH2 ═ CH2 + H2 CH3 ― CH3
Этилен этан
2) ацетилен легко присоединяет галогены (также в две стадии).
CH ≡ CH + Br2 CHBr ═ CHBr ; CHBr ═ CHBr + Br2 → CHBr2 – CHBr2
Бромная вода при этом обесцвечивается (качественная реакция на ацетилен (на кратную связь)).
Продукты реакции: 1,2 – дибромэтен; 1,1,2,2 – тетрабромэтан
3) 
 ацетилен присоединяет воду в присутствии катализатора – солей ртути с образованием уксусного альдегида (реакция Кучерова): O
ацетилен присоединяет воду в присутствии катализатора – солей ртути с образованием уксусного альдегида (реакция Кучерова): O

 CH ≡ CH + H – OH CH3 ― C
CH ≡ CH + H – OH CH3 ― C
H уксусный альдегид
Эта реакция в обычных условиях не протекает. Этой реакцией в промышленности получают уксусный альдегид, а из него при восстановлении – этиловый спирт, а при окислении – уксусную кислоту.
4) ацетилен присоединяет галогеноводороды аналогично этилену.
5) при соединении 3-х молекул ацетилена (полимеризация) при температуре
500 градусов в присутствии катализатора (активированный уголь) образуется бензол:
 3 C2H2 C6H6
3 C2H2 C6H6
6) Реакции окисления. Ацетилен горит на воздухе коптящим пламенем. Но если в пламя вдувать кислород, то ацетилен горит ослепительно белым пламенем. При этом температура достигает 3500 градусов. Эта реакция используется при резке и сварке металлов.
 2C2H2+5O2 4CO2 + 2H2O + Q
2C2H2+5O2 4CO2 + 2H2O + Q
Смеси ацетилена с воздухом и кислородом взрывоопасны.
Получение: в промышленности ацетилен получают дегидрированием метана:
 2CH4 CH ≡ CH + 3H2
2CH4 CH ≡ CH + 3H2
Применение: из ацетилена получают уксусный альдегид, уксусную кислоту, синтетический каучук, поливинилхлорид; его используют для автогенной сварки металлов. Из него получают тетрахлорэтан – хороший пожаробезопасный растворитель жиров и многих органических веществ.
| <== предыдущая лекция | | | следующая лекция ==> |
| Компенсация и методика нисходящего проектирования СУ. | | | Методы исследования систем управления. |
Дата добавления: 2016-05-05; просмотров: 2182;
