По признаку обратимости.
По числу и составу исходных и образующихся веществ.
А) Реакции разложения, когда из одного вещества получаются два или несколько других веществ:
t > 1000 ˚ C
CaCO3 —————→ CaO + CO2 ↑
t°C
2CH4 ———→ C2H2 + 3H2↑
Б) Реакции соединения, когда из двух или нескольких веществ образуется одно новое вещество:
t°
2Cu + O2 ――→2CuO
O
кат. ⁄ ⁄
H—C≡C—H + HOH ——→ CH3—C
\
H
В) Реакции замещения, протекающие между простыми и сложными веществами, когда атомы простого вещества замещают атомы одного из элементов в сложном веществе:
Fe + CuCl2 ———→ Cu ↓ + FeCl2
Zn + 2HCl ———→ ZnCl2 + H2↑
свет
CH4 + Cl2 ———→ CH3Cl + HCl
Г) Реакции обмена, протекающие между двумя сложными веществами, когда их составные части обмениваются местами:
AlCl3 + 3AgNO3———→ Al(NO3)3 + AgCl ↓
По тепловому эффекту.
А) Экзотермические – реакции, протекающие с выделением энергии:
C + O2 ↑ ———→ CO2 + Q
Б) Эндотермические – реакции, протекающие с поглощением энергии:
пост. ток
2H2O —————→ 2H2 ↑ + O2 – Q
Количество теплоты, которое выделяется или поглощается при химической реакции, называется тепловым эффектом реакции.
Химические уравнения, в которых указывается тепловой эффект, называются термохимическими.
По признаку обратимости.
А) Необратимые – реакции, в которых исходные вещества полностью превращаются в другие вещества:
HCl + Ag NO3 ——→ AgCl↓ + HNO3
Na2SO4 + BaCl2 ——→ 2NaCl + BaSO4
Б) Обратимые – реакции, протекающие при данных условиях во взаимно
противоположных направлениях:

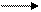 SO2+ H2O H2SO3
SO2+ H2O H2SO3
t, p, кат.
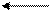
 N2+ 3H2 2NH3
N2+ 3H2 2NH3
| <== предыдущая лекция | | | следующая лекция ==> |
| Типовые динамические звенья. | | | Крахмал и целлюлоза – представители полисахаридов. |
Дата добавления: 2016-05-05; просмотров: 688;
